Nature:张锋团队最新研究:可将蛋白递送至任何指定人类细胞,或打破基因治疗困局 |
 |
来源:生物探索 2023-04-04 13:16
张锋团队又在Nature上发表重磅研究“Programmable protein delivery with a bacterial contractile injection system”。文中介谈起基因编辑,就不得不提及大名鼎鼎的CRISPR/Cas系统。这一技术源自于人类向细菌的学习,其大致原理为,在CRISPR RNA(crRNA)的引导下,与之结合在一处的Cas蛋白能够找到与crRNA互补的目标DNA序列,并通过切割这段DNA,触发DNA修复机制,实现基因编辑。
因此,若要使用CRISPR/Cas系统进行基因编辑,将Cas蛋白和crRNA导入到细胞内是必不可少的。然而,这也成为了该技术的使用瓶颈之一。
目前主流的递送技术分为两类,一类是利用较为安全的腺相关病毒(adeno-associated virus,AAV)作为载体,另一类是诸如脂质纳米颗粒(LNP)的非病毒载体。但这两种方式各有其局限性,前者容易激发反应,带来不良反应;后者则容易对肝脏被动靶向,不利于肝外递送。
麻省理工学院布罗德研究所和哈佛大学的分子生物学家、CRISPR/Cas技术先驱张峰表示: 递送是基因编辑的主要瓶颈之一,目前的递送方法限制了大多数临床试验只能编辑肝脏、眼部或血细胞的基因组,脑部或肾脏疾病则因为没有可用的递送系统而无法得到解决。
今年2月,张锋教授联合创建的Aera Therapeutics公司宣布正式成立,该公司推出了一种称为蛋白质纳米颗粒(PNP)的递送平台技术,获得了近2亿美元的融资。这一平台的思路是,利用人体内天然存在逆转录病毒样蛋白,自我组装成的类似病毒衣壳的 空壳 结构,将CRISPR/Cas系统以mRNA的形式递送到目标细胞。我们曾在《》一文中有过相关报道。
3月30日,张锋团队又在Nature上发表重磅研究 Programmable protein delivery with a bacterial contractile injection system 。文中介绍了一种全新的蛋白递送系统,有望将任何蛋白地送到任何目标人类细胞。

图1 研究成果(图源:[1])
这一系统的灵感同样是来自于对自然界的借鉴。
2019年,北京大学高宁团队和中国医学科学院病原生物学研究所金奇团队合作,对一种名为收缩注射系统(Contractile injection systems , CIS)的精细结构进行了解析。CIS是一种大量存在于细菌和古细菌之中的类似于注射器的大分子复合物,可通过细胞膜驱动刺突,将管腔内的蛋白质载荷注入到其所识别的目标真核细胞中。
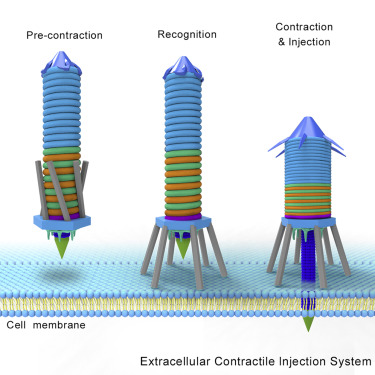
图2 CIS概念图(图源:[2])
医药网新闻
- 相关报道
-
- PNAS:精子也“飙车”?科学家发现能量开关,有望颠覆不孕与避孕未来 (2025-10-16)
- Cell:小胶质细胞-星形胶质细胞交谈调节突触重塑 (2025-10-16)
- 香港西医病院开院首年将提供门诊及日间住院等服务 (2025-10-16)
- 国度药监局对于刊出氯雷他定片等80个药品注册证书的布告 (2025-10-16)
- 《自然·神经科学》:从身到心,一次改善!单剂量裸盖菇素可快速且持续地缓解慢性疼痛小鼠痛觉异常和情绪障碍 (2025-10-16)
- 山东优化养老服务网络 变“养老”为“享老” (2025-10-16)
- Nature Medicine:当新生儿筛查遇上基因组测序,我们准备好了吗? (2025-10-16)
- 颜宁团队连发两篇论文:解析“酷寻”策略发现的全新糖纤维结构,并开发绝对手性判定新算法 (2025-10-16)
- Cell:里程碑式突破!I/IIa期临床试验证实hESC衍生细胞移植可安全并有效地重建帕金森病患者的多巴胺能系统 (2025-10-16)
- 抑郁不只是“情绪感冒”!Science 子刊揭密:大脑糖链“脱落”才是关键,靶向修复或破治疗困局 (2025-10-15)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















