效果堪比自体CAR |
 |
来源:生物世界 2023-04-17 17:02
这些发现表明,基于异基因的HIP CAR-T细胞的“通用型”细胞疗法,可能克服与异基因CAR-T细胞持久性差的限制,发挥更持久的抗肿瘤反应。细胞疗法(嵌合抗原受体T细胞疗法)是一种创新的癌症疗法,目前,已批准了5款CAR-T细胞疗法上市,用于治疗、和骨髓瘤等血液瘤。这几款均为自体CAR-T细胞疗法,这种从癌症患者自身T细胞定制的疗法价格昂贵,且需要复杂的生产流程,可扩展性有限,而且在不同患者间质量差异较大,导致治疗效果难以预测。此外,对于病情进展较快的癌症患者来说,这种自体CAR-T细胞疗法的生产周期会导致治疗延误。
现货型 的异基因CAR-T细胞疗法具有克服上述挑战的潜力,从而为更广大的癌症患者带来细胞治疗的机会。但这种异基因CAR-T细胞疗法也面临着两大障碍。首先,异基因CAR-T细胞可能导致移植物抗宿主病(GvHD),其次,异基因CAR-T细胞可能被宿主免疫系统迅速消除,即所谓的宿主抗移植物病(HvGD),从而限制其抗肿瘤活性。这导致了当前的 通用型 CAR-T细胞疗法易受到免疫排斥,难以在患者体内持续存在,因此不足以产生比肩自体CAR-T细胞疗法的效果。
近日,Sana Biotechnology的研究人员在NatureCommunications期刊发表了题为:Hypoimmune anti-CD19 chimeric antigen receptor T cells provide lasting tumor control in fully immunocompetent allogeneic humanized mice的研究论文。
该研究通过CRISPR-Cas9基因编辑敲除了T细胞的TRAC、B2M和CIITA基因,从而构建出了人类低免疫(HIP)T细胞。然后,使用慢病毒载体让这些HIP T细胞过表达CD47和CD19 CAR,构建出了异基因HIP CD19 CAR-T细胞。
该研究进一步证明了,异基因HIP CD19 CAR-T细胞在免疫功能正常的人源化小鼠肿瘤模型中是安全的,且能够实现持久、有效的肿瘤清除效果。
该研究表明,基于低免疫T细胞的 通用型 CAR-T细胞疗法能够达到目前只有自体CAR-T细胞疗法才能达到的治疗效果,这有助于更广大的癌症患者及时获得细胞治疗。
目前已经有一些临床试验使用CRISPR-Cas9基因编技术来构建 通用型 CAR-T细胞。例如,敲除T细胞的TRAC基因(表达T细胞受体 链),从而消除T细胞受体(TCR),避免移植物抗宿主病(GvHD),敲除T细胞的CD52,可在抗CD52单抗存在的情况下提高通用型 通用型 CAR-T细胞细胞的扩增持久性。然而,长期使用抗CD52单抗治疗可能会增加毒性和机会性感染的风险。
尽管目前有各种基于基因编辑的 通用型 CAR-T细胞疗法,但它们的抗肿瘤反应和持久性通常不如自体CAR-T治疗有效。
向患者移植 通用型 CAR-T细胞后,还要预防人体免疫系统对这些CAR-T细胞的排斥,即排异反应。敲除B2M和CIITA基因,从而消除人类白细胞抗原(HLA),能够阻止排异反应,但这也会导致这些CAR-T细胞容易被先天免疫杀伤。而CD47是一种 别吃我 信号,过表达CD47能够防止被先天免疫细胞杀伤。
在这项研究中,Sana Biotechnology的研究团队目标是开发出 通用型 异基因CAR-T细胞,以逃避患者免疫系统并产生持久的抗肿瘤反应。

研究团队使用CRISPR-Cas9基因编辑技术,敲除了T细胞的TRAC、B2M和CIITA基因,从而构建出了人类低免疫(HIP)T细胞。然后,使用慢病毒载体让这些HIP T细胞过表达CD47和CD19 CAR,构建出了异基因HIP CD19 CAR-T细胞。
研究团将这些异基因HIP CD19 CAR-T细胞与只表达了CD19 CAR的异基因CD19 CAR-T细胞进行比较。
体外癌症杀伤和耗竭实验显示,异基因CD19 CAR-T细胞和异基因HIP CD19 CAR-T细胞之间没有差异,这证实了通过CRISPR-Cas9基因编辑构建的低免疫(HIP)没有对T细胞性能产生负面影响。
在免疫缺陷小鼠中,异基因HIP CD19 CAR-T细胞对CD19阳性肿瘤的清除效果,与异基因CD19 CAR-T细胞。
更重要的是,在免疫功能正常的人源化小鼠模型中,异基因HIP CD19 CAR-T细胞明显优于异基因CD19 CAR-T细胞,展现了更好的持久性和扩增能力,并且带来了持久的肿瘤清除效果。
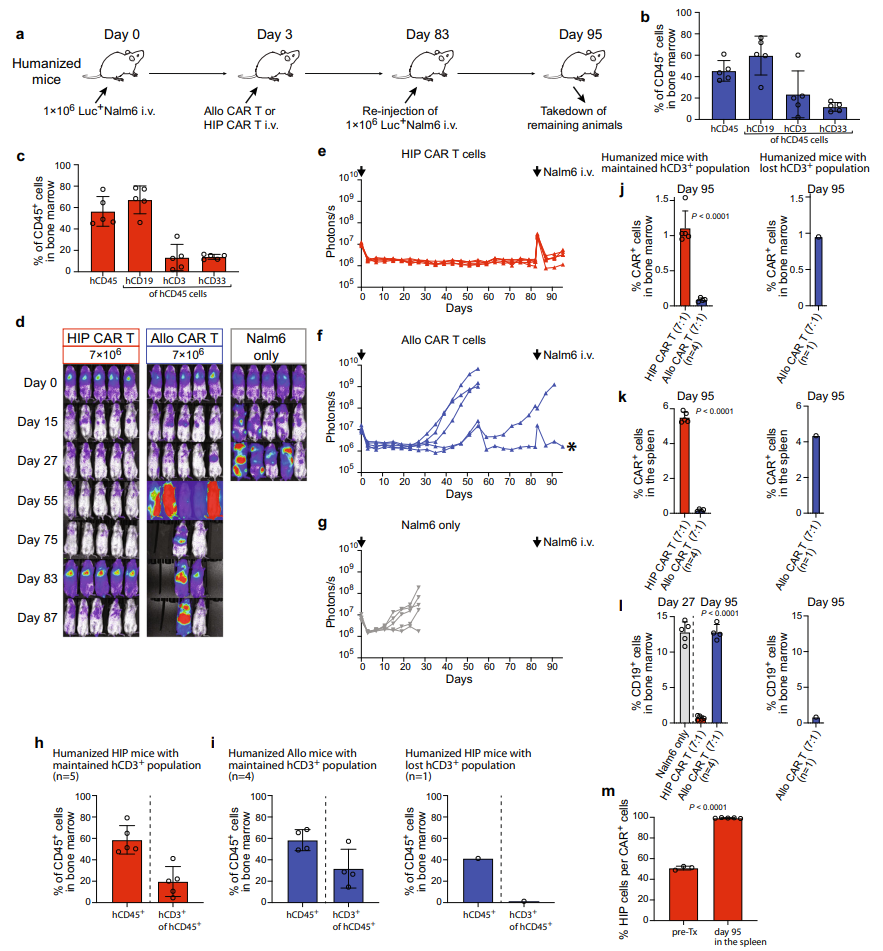
此外,研究团队还考虑到了CD47过表达可能带来的潜在失控问题,他们使用CD47靶向融合蛋白,抑制CD47的过表达,能够可靠且特异性地消除体内的异基因HIP CD19 CAR-T细胞。
这些发现表明,基于异基因的HIP CAR-T细胞的 通用型 细胞疗法,可能克服与异基因CAR-T细胞持久性差的限制,发挥更持久的抗肿瘤反应。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- ESMO创纪录!中国药企策略跃迁:从大单品到“爆品链” (2025-10-19)
- 登上Cell封面:中国科学院将CRISPR基因编辑与AI机器人结合,推动可持续农业发展 (2025-10-19)
- Nature子刊:启动子编辑,实现对转基因表达的精准调控 (2025-10-19)
- Nature Biotechnology:合成生物学新里程碑——DIAL框架下的启动子编辑新策略,实现基因表达的“无级变速” (2025-10-19)
- Science:我们与线粒体的古老契约——细胞如何清理“坏基因”? (2025-10-19)
- Nature:解剖代谢“双城”——AI深度学习揭示肝肠内部的功能新图景 (2025-10-18)
- JEM:黄波/张晓辉团队破解JAK2V617F突变引发血小板抑或红细胞增多的分子机制 (2025-10-18)
- 利奥制药在中国递交上市许可申请,持续推进Anzupgo®(德戈替尼乳膏)的全球可及 (2025-10-17)
- Nature:破解遗传密码!汉族人群多基因风险评分的突破性研究 (2025-10-17)
- Nature 揭秘大脑“我意已决”的瞬间:AI 抓包大脑“关门拒听”瞬间,神经轨迹突然大转弯 (2025-10-17)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















