《科学》子刊:科学家发现星形胶质细胞功能障碍导致认知障碍的新机制! |
 |
来源:奇点糕 2023-05-22 09:21
一项新研究[6]发现,星形胶质细胞细胞质中TDP-43的积累促进干扰素诱导的趋化因子基因表达,产生过量的趋化因子,激活海马神经元的趋化因子受体,改变突触前功能并使神经元过度兴奋在大约一半的(AD)患者、大多数海马硬化患者和其他几种痴呆症患者中,都存在反式激活反应DNA结合蛋白43(TDP-43)失调,并且与认知障碍有关[1-5]。
TDP-43是一种在细胞核中广泛存在的蛋白质,TDP-43的错误定位、缺失或突变可以引起细胞功能缺陷和毒性,尽管已经在多种神经系统疾病中发现了TDP-43病理变化,但TDP-43导致发病和认知障碍的机制还是个谜。
在最近的《科学 进展》杂志上,一项新研究[6]发现,星形胶质细胞细胞质中TDP-43的积累促进干扰素诱导的趋化因子基因表达,产生过量的趋化因子,激活海马神经元的趋化因子受体,改变突触前功能并使神经元过度兴奋,从而导致认知障碍的发生。

神经胶质细胞和神经元中功能失调的TDP-43均可以导致神经系统疾病,但小鼠研究显示,在运动神经元中选择性敲除突变的TDP-43可延迟疾病发作,但并不影响疾病进展,因此,非神经元中的TDP-43可能才是长期病理进展的罪魁祸首[7]。
星形胶质细胞的TDP-43靶向敲除可以引起运动障碍[8],而且肌萎缩性脊髓侧索硬化症(ALS)患者来源的诱导性多能衍生的星形胶质细胞也表现出细胞质中自主的TDP-43积累[9]。
因此,研究人员首先利用尸检海马切片对AD、额颞叶痴呆(FTD)患者和非痴呆对照组星形胶质细胞中TDP-43的亚细胞水平进行了评估,与对照组相比,AD患者海马星形胶质细胞中弥漫性核外TDP-43水平增加了89%,散发型和家族型FTD患者中也有类似的现象。
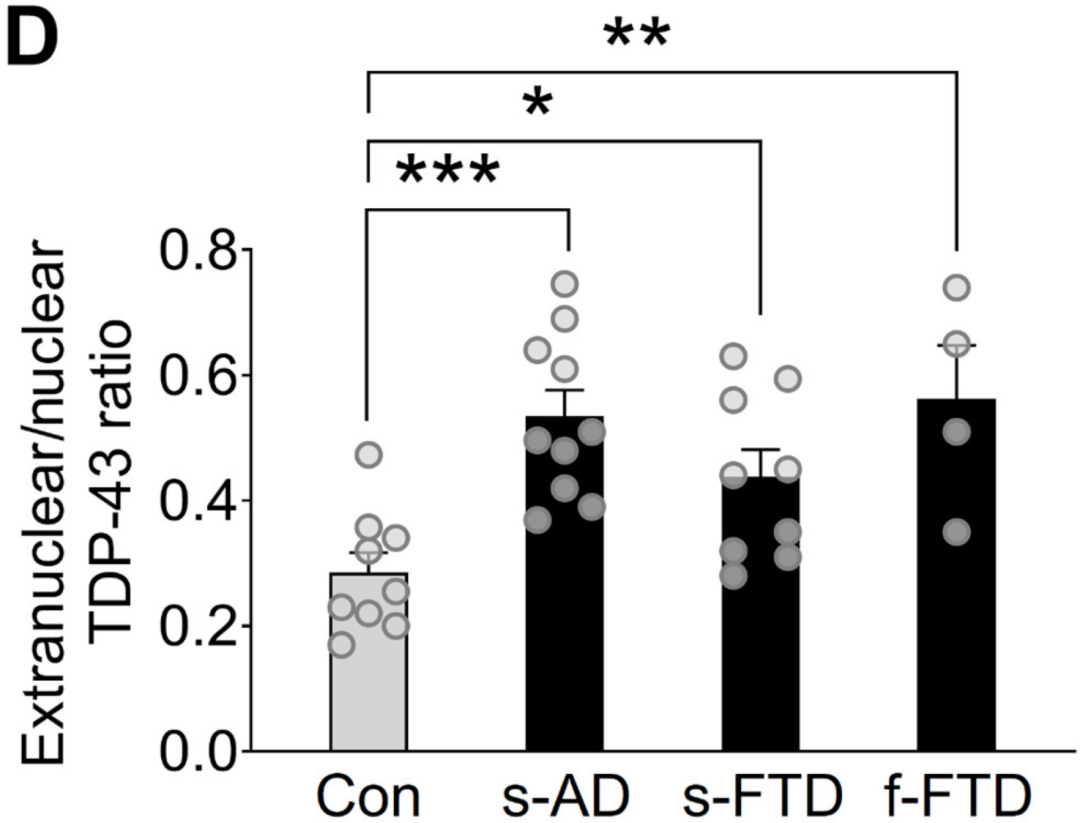
AD和FTD患者核外TDP-43水平显著增加
研究人员对小鼠进行了转基因,使小鼠的星形胶质细胞靶向表达人类的TDP-43突变形式,在细胞质中积累。
小鼠在3-4个月龄时,在水迷宫实验中表现出正常的学习能力,1天后进行的记忆能力测试中表现正常,但3天后的重复测试表现出中度记忆能力受损。到了9-10月龄时,小鼠在1天和3天时的记忆能力测试表现都很糟糕,但游泳和学习能力没有受到影响。12月龄时,小鼠在识别新物体方面也出现了问题。这样的变化表明,星形胶质细胞TDP-43细胞质积累会引起进行性记忆障碍。
与Tau-P301S小鼠(表达tau和MAPT*P301S突变的AD和FTD模型)海马基因表达广泛变化相比,TDP-43突变小鼠的海马基因表达具有高度选择性,干扰素(IFN)诱导的趋化因子Cxcl9和Cxcl10是受影响最大的基因,在海马中表达大量增加,但在其他脑区中变化极小,CXCL9和CXCL10的增加也局限于海马星形胶质细胞,其他脑区的神经元、小胶质细胞/巨噬细胞或星形胶质细胞中没有这种变化,与此前在AD患者中的发现相似。
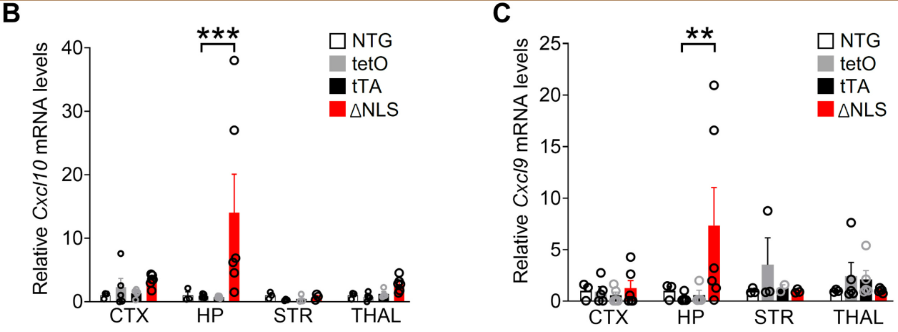
Cxcl10(B)和Cxcl9(C)的表达在海马(HP)中大量增加
体外培养的结果显示,IFN诱导的多个基因的变化至少部分是细胞自主的,分离的星形胶质细胞中观察到磷酸化NF- B水平的增加,支持TDP-43功能障碍影响星形胶质细胞中相关信号通路的观点。
实验显示,与对照组相比,TDP-43积累后,星形胶质细胞水疱性口炎病毒(VSV)、腺病毒和单纯疱疹病毒-1(HSV-1)感染水平增加,这表明,TDP-43功能障碍不仅影响认知功能,还会使抗病毒反应受损,这可能使患者易患病毒性传染病。
虽然TDP-43直接影响星形胶质细胞,但小鼠的记忆能力受损,说明星形胶质细胞和神经元之间一定发生了什么,IFN诱导的趋化因子CXCL9和CXCL10能够激活相应的受体CXCR3,这一受体在神经元、小胶质细胞和其他一些细胞中表达,不过海马CXCR3主要在神经元中表达,看来CXCR3嫌疑很大。
研究人员发现,小鼠海马Cxcr3RNA和CXCR3水平确实增加了,CXCR3和不同突触前突触后标志物的共免疫标记显示,CXCR3选择性地在突触前标志物突触素阳性点内增加了2倍,在突触后密度蛋白-95(PSD-95)或桥尾蛋白阳性点内则没有,这表明,海马CXCR3的增加仅发生在突触前末端。
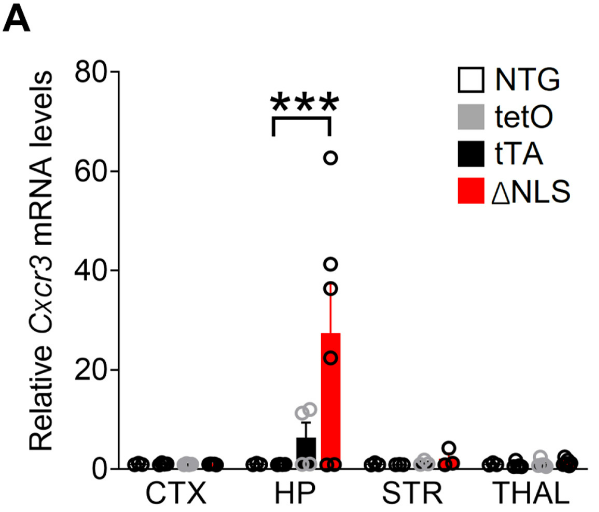
Cxcr3表达明显增加
长期、慢性的CXCR3刺激增加了自发的神经元活动,神经元放电长期增加,从而产生了认知障碍。研究人员尝试阻断了小鼠海马神经元CXCR3,小鼠在水迷宫中的表现恢复到和野生小鼠同样的水平,佐证了星形胶质细胞TDP-43功能障碍以CXCR3依赖性的方式导致记忆能力受损。
研究人员表示,这提示他们,为了有效治疗AD和痴呆,需要同时考虑星形胶质细胞和神经元,目前,CXCR3阻断剂已经在临床试验中用于治疗关节炎和其他炎症性疾病,他们希望能够在痴呆患者中使用这些药物进行测试。
参考文献:
[1] Uryu K, Nakashima-Yasuda H, Forman M S, et al. Concomitant TAR-DNA-binding protein 43 pathology is present in Alzheimer disease and corticobasal degeneration but not in other tauopathies[J]. Journal of Neuropathology Experimental Neurology, 2008, 67(6): 555-564.
[2] Davidson Y S, Raby S, Foulds P G, et al. TDP-43 pathological changes in early onset familial and sporadic Alzheimer s disease, late onset Alzheimer s disease and Down s syndrome: association with age, hippocampal sclerosis and clinical phenotype[J]. Acta neuropathologica, 2011, 122: 703-713.
[3] Josephs K A, Murray M E, Whitwell J L, et al. Staging TDP-43 pathology in Alzheimer s disease[J]. Acta neuropathologica, 2014, 127: 441-450.
[4] Nag S, Yu L, Capuano A W, et al. Hippocampal sclerosis and TDP‐43 pathology in aging and A lzheimer disease[J]. Annals of neurology, 2015, 77(6): 942-952.
[5] Buciuc M, Tosakulwong N, Machulda M M, et al. TAR DNA-Binding Protein 43 is associated with rate of memory, functional and global cognitive decline in the decade prior to death[J]. Journal of Alzheimer s Disease, 2021, 80(2): 683-693.
[6] Licht-Murava A, Meadows S M, Palaguachi F, et al. Astrocytic TDP-43 dysregulation impairs memory by modulating antiviral pathways and interferon-inducible chemokines[J]. Science Advances, 2023, 9(16): eade1282.
[7] Ditsworth D, Maldonado M, McAlonis-Downes M, et al. Mutant TDP-43 within motor neurons drives disease onset but not progression in amyotrophic lateral sclerosis[J]. Acta neuropathologica, 2017, 133: 907-922.
[8] Peng A Y T, Agrawal I, Ho W Y, et al. Loss of TDP-43 in astrocytes leads to motor deficits by triggering A1-like reactive phenotype and triglial dysfunction[J]. Proceedings of the National Academy of Sciences, 2020, 117(46): 29101-29112.
[9] Serio A, Bilican B, Barmada S J, et al. Astrocyte pathology and the absence of non-cell autonomy in an induced pluripotent stem cell model of TDP-43 proteinopathy[J]. Proceedings of the National Academy of Sciences, 2013, 110(12): 4697-4702.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 终结持续25年的争论!娄智勇/饶子和等团队合作最新Cell (2025-10-26)
- 上海药物所×临港实验室合作发表Cell论文:基于结构发现新型抗抑郁小分子 (2025-10-26)
- Mol Cancer:阻断甲状腺激素受体为前列腺癌治疗提供了新的途径 (2025-10-26)
- Science子刊:卞修武团队发现增强CAR-T细胞抗肿瘤效果的基因修饰策略 (2025-10-26)
- Nature Biotechnology:直击囊胚“混沌期”——长时程活体成像首次捕捉人类囊胚的染色体分离灾难 (2025-10-26)
- JNCCN:戒烟也应当是癌症治疗的一环!13万名癌症患者数据分析结果显示,癌症确诊后及时戒烟可大幅降低死亡风险,改善手术预后 (2025-10-26)
- NEJM:人工视网膜,帮助老年性黄斑变性患者恢复视力 (2025-10-25)
- 华中师范大学最新Cell子刊论文:开发治疗白血病的多肽类药物 (2025-10-25)
- 《科学》:膳食脂肪重塑昼夜节律!加州大学科学家发现,饮食中不饱和脂肪酸比例会影响昼夜节律,是人体生物钟与季节匹配与否的关键 (2025-10-25)
- 河南中州实验室发表Nature Metabolism论文:揭开大脑髓鞘再生修复的关键 (2025-10-25)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















