Science子刊:CAR |
 |
来源:生物世界 2023-09-06 11:44
据悉,研究团队正在进行进一步的毒理实验,并在其他模型中进行验证,为进入人体临床试验做准备。宾夕法尼亚大学佩雷尔曼医学院SaarGill教授、Carl June教授等在Science子刊Science Translational Medicine上发表了题为:Epitope base editing CD45 in hematopoietic cells enables universal blood cancer immune therapy的研究论文。
CD45存在于几乎所有的血液细胞表面(当然也包括血液癌细胞),该研究使用腺嘌呤碱基编辑器(ABE)开发了一种 表位编辑 策略,碱基编辑后CD45能够在血液系统内正常工作,而又不被细胞识别。
使用这种 表位编辑 策略对造血和CAR-T细胞进行改造,输入体内后,这些靶向CD45的CAR-T细胞不会自相残杀,也不会杀死输入的表位编辑的造血干细胞,但能够杀死表达正常CD45的血液癌细胞。

论文共同通讯作者、宾夕法尼亚大学细胞疗法中心主任Carl June教授表示,目前CAR-T细胞疗法的一个缺点是,每种疗法必须根据不同癌症类型的靶点单独开发。而这项研究为更通用的方法奠定了基础,有望将CAR-T细胞疗法扩展到所有血液类癌症。
CD45存在于几乎所有的血液细胞表面,并且通常在血液肿瘤细胞上高表达。如果直接开发一款靶向CD45的CAR-T细胞疗法,确实可以清除血液肿瘤细胞,但这会清除患者其他健康的血液细胞,包括红细胞、血小板,甚至是产生新的血细胞的骨髓干细胞。此外,T细胞也属于血液细胞,通常也表达CD45,因此,靶向CD45的CAR-T细胞疗法在输入患者体内之前就会发生自相残杀。
为了克服这一挑战,研究团队使用碱基编辑(base editing)技术开发了一种表位编辑新策略,这涉及CAR-T细胞和造血干细胞(HSC)的基因编辑,以改变CAR-T细胞与CD45蛋白结合的 表位 。碱基编辑后的CD45仍然有效,但与正常CD45有很大差异,因此靶向CD45的CAR-T细胞不能识别和攻击它们。
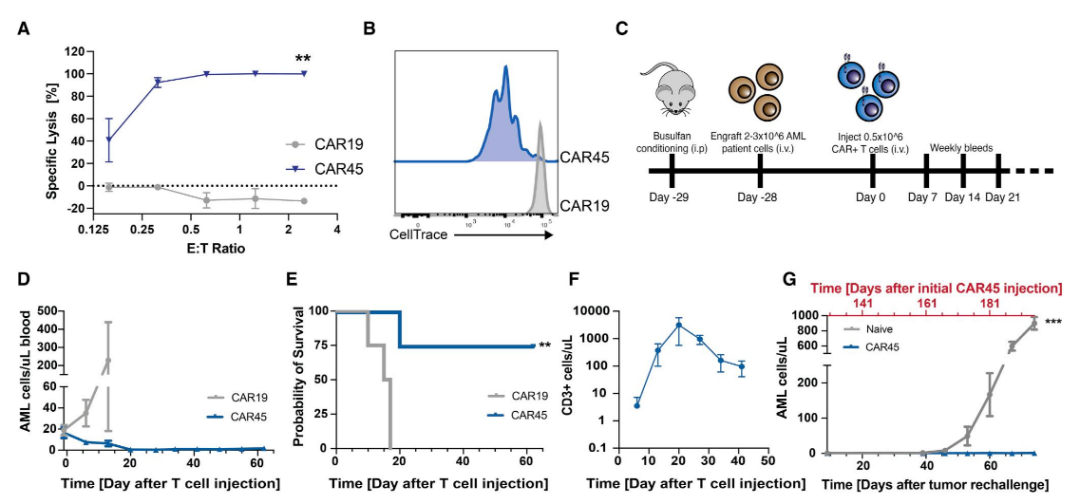
因此,这本质上是造血干细胞移植和CAR-T细胞疗法的结合。当这些编辑后的靶向CD45的CAR-T细胞输入后,能够杀死携带正常CD45的血液癌细胞,包括患者来源的急性髓系、B细胞和急性T细胞白血病。但它们不会自相残杀,也不会杀死移植的表位编辑的造血干细胞。直接基因敲除CD45的造血干细胞不同的是,表位编辑的造血干细胞能够植入、持续存在和分化,从而产生新的血液细胞。
研究团队在细胞和小鼠模型中进行了大量实验,以测试了这一表位编辑策略的可行性。试验结果显示,这种新方法不仅可以阻止靶向CD45的CAR-T细胞的自相残杀或攻击表位编辑的造血干细胞,而且可以迅速摧毁血液癌细胞。在小鼠实验中,靶向CD45的CAR-T细胞在输入后3周内消除了白血病细胞,并且在两个多月后仍然存在并且能够持续杀死白血病细胞。
据悉,研究团队正在进行进一步的毒理实验,并在其他模型中进行验证,为进入人体临床试验做准备。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 终结持续25年的争论!娄智勇/饶子和等团队合作最新Cell (2025-10-26)
- 上海药物所×临港实验室合作发表Cell论文:基于结构发现新型抗抑郁小分子 (2025-10-26)
- Mol Cancer:阻断甲状腺激素受体为前列腺癌治疗提供了新的途径 (2025-10-26)
- Science子刊:卞修武团队发现增强CAR-T细胞抗肿瘤效果的基因修饰策略 (2025-10-26)
- Nature Biotechnology:直击囊胚“混沌期”——长时程活体成像首次捕捉人类囊胚的染色体分离灾难 (2025-10-26)
- JNCCN:戒烟也应当是癌症治疗的一环!13万名癌症患者数据分析结果显示,癌症确诊后及时戒烟可大幅降低死亡风险,改善手术预后 (2025-10-26)
- NEJM:人工视网膜,帮助老年性黄斑变性患者恢复视力 (2025-10-25)
- 华中师范大学最新Cell子刊论文:开发治疗白血病的多肽类药物 (2025-10-25)
- 《科学》:膳食脂肪重塑昼夜节律!加州大学科学家发现,饮食中不饱和脂肪酸比例会影响昼夜节律,是人体生物钟与季节匹配与否的关键 (2025-10-25)
- 河南中州实验室发表Nature Metabolism论文:揭开大脑髓鞘再生修复的关键 (2025-10-25)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















