PNAS:王本/张进团队构建基因编辑的iPSC来源的CAR |
 |
来源:生物世界 2023-09-13 17:23
综合来看,该研究发现了肿瘤细胞表面的唾液酸在抗体依赖性细胞吞噬(ADCP)和细胞介导的细胞毒性(ADCC)中的抑制作用,有针对性地清除肿瘤细胞表面的唾液酸显著增强了巨噬细胞对肿瘤细胞的敏感性。浙江大学转化医学研究院/医学院附属第二医院王本课题组与良渚实验室/浙江大学基础医学院张进课题组合作,在《美国国家科学院院刊》(PNAS)上发表了题为:Targeted glycan degradation potentiates cellular immunotherapy for solid tumors的论文。
该研究发现了唾液酸酶与人诱导多能(iPSC)来源的CAR-巨噬细胞(CAR-iMac)联用可以显著增强CAR-iMac的抗实体瘤功能。另外,同时敲除巨噬细胞表面与唾液酸酶结合的检查点Siglec-5和Siglec-10(DKO-CAR-iMac)也可以显著增强CAR-iMac的抗实体瘤功能。
这些发现为髓系细胞在细胞免疫治疗上的应用提供了新思路。细胞疗法先驱、宾夕法尼亚大学的Carl June教授是这篇论文的责任编辑。

外周血单核细胞(PBMC)来源的原代巨噬细胞无法高效进行基因编辑和工程化改造,因此iPSC来源的巨噬细胞(iMac)成为髓系细胞免疫治疗的重要来源。研究团队首先用唾液酸酶预处理细胞SKOV3,并将SKOV3细胞与靶向间皮素的CAR-iMac(MSLN-CAR-iMac)共培养。结果表明,唾液酸酶的预处理不会影响肿瘤细胞自身的生长速度,但可以显著提高MSLN-CAR-iMac对卵巢癌细胞的吞噬能力。研究团队还发现,唾液酸酶的预处理提高了共培养体系中M1型CAR-iMac的比例和肿瘤坏死因子 (TNF- )的分泌(图1)。
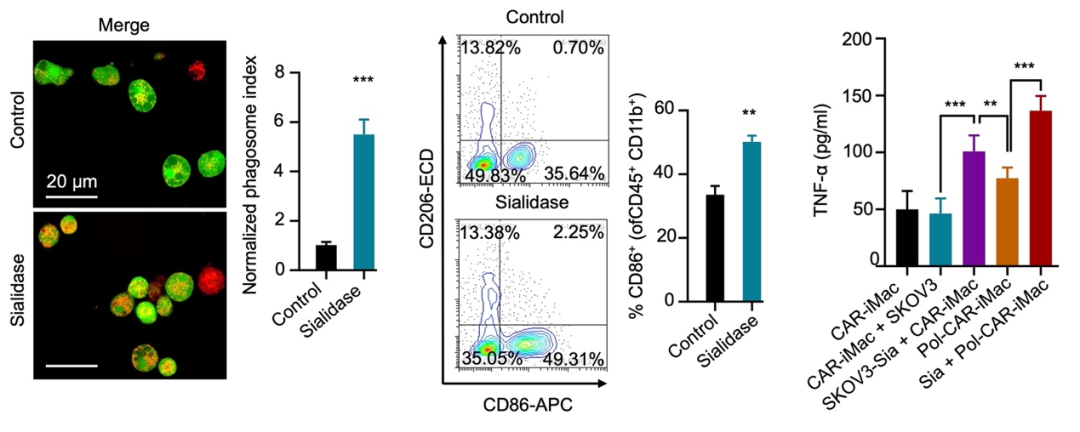
图1.唾液酸酶提高了CAR-iMac的促炎极化水平和对肿瘤细胞的吞噬能力
研究团队还用NSG小鼠构建了卵巢癌转移小鼠模型,并观察了通过腹腔注射CAR-iMac和唾液酸酶治疗后小鼠肿瘤的变化。可以看到,单独的唾液酸酶几乎没有治疗作用,而唾液酸酶与CAR-iMac联用可以显著抑制肿瘤生长并延长了小鼠的生存期(图2)。后续在小鼠模型中与原位卵巢癌小鼠模型中也分别观察到唾液酸酶与CAR-iMac联用可以显著延长小鼠的生存期(图3)。
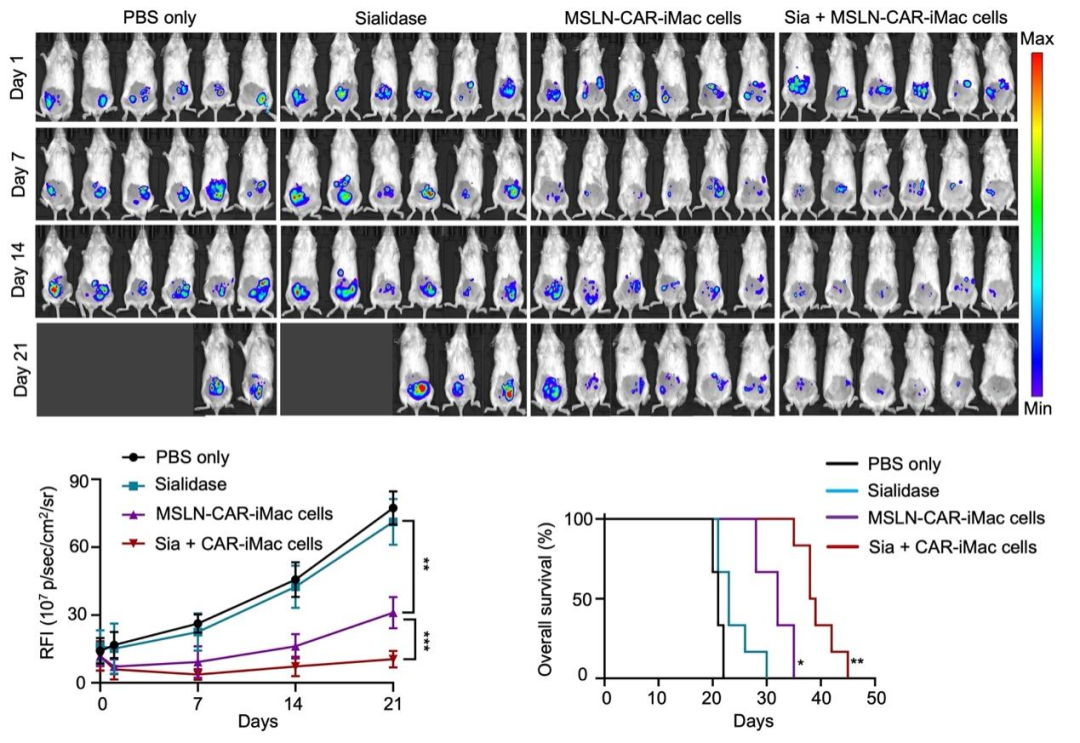 图2. 在卵巢癌转移小鼠模型中,唾液酸酶与CAR-iMAC联用可以显著提高疗效
图2. 在卵巢癌转移小鼠模型中,唾液酸酶与CAR-iMAC联用可以显著提高疗效
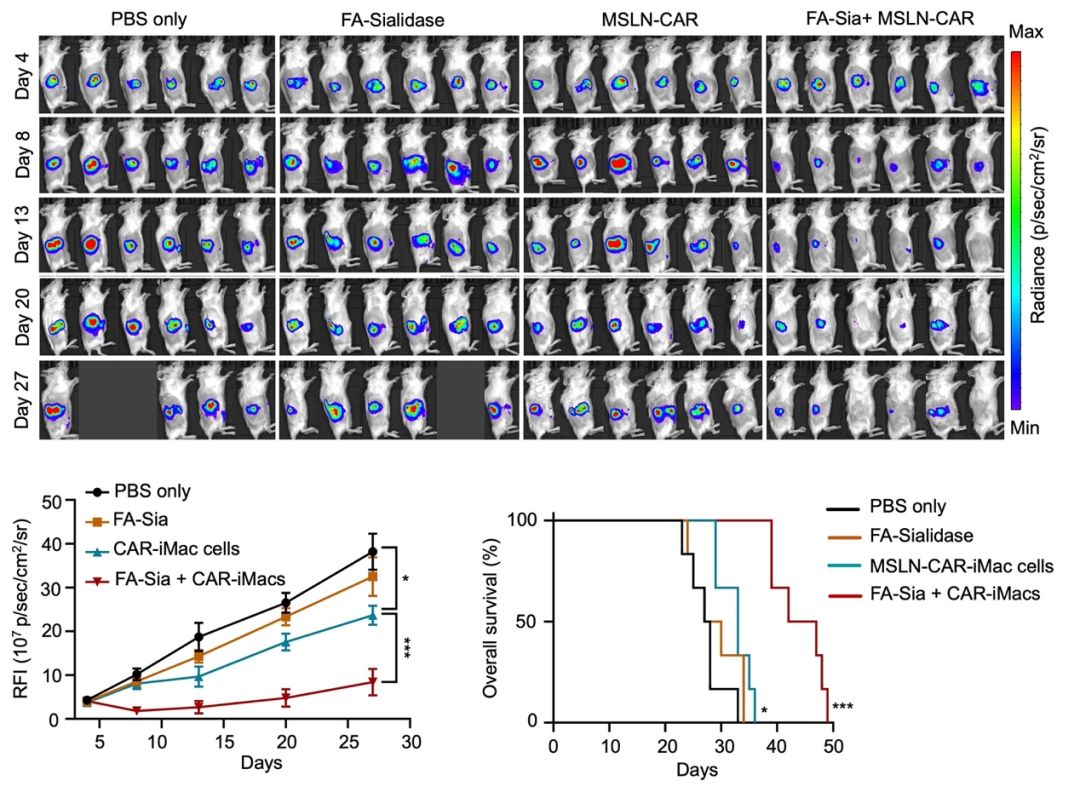 图3.在原位卵巢癌小鼠模型中,唾液酸酶与CAR-iMAC联用可以显著提高疗效
为了探索唾液酸酶增强CAR-iMac抗肿瘤功能的机制,研究团队分析了iMac分化过程中和iMac与肿瘤细胞共培养过程中各种唾液酸酶受体Siglecs的表达情况,将可能发挥作用的唾液酸酶受体定位在Siglec-1、Siglec-5、Siglec-10和Siglec-15。又进一步通过中和抗体试验定位于Siglec-5和Siglec-10两个唾液酸酶受体。于是,研究团队利用CRISPR-Cas9基因编辑技术在iPSC中同时敲除了Siglec-5和Siglec-10,并通过诱导分化获得Siglec-5和Siglec-10双敲除的CAR-iMac(DKO-CAR-iMac)。后续的实验结果表明,DKO-CAR-iMac具有增强的肿瘤细胞吞噬能力和杀伤能力,显著抑制小鼠体内肿瘤细胞的生长,并延长了小鼠的生存期。DKO-CAR-iMac单独给药的疗效可以达到CAR-iMac与唾液酸酶联用的疗效,而且DKO-CAR-iMac与唾液酸酶联用无法进一步提升其疗效(图4)。
图3.在原位卵巢癌小鼠模型中,唾液酸酶与CAR-iMAC联用可以显著提高疗效
为了探索唾液酸酶增强CAR-iMac抗肿瘤功能的机制,研究团队分析了iMac分化过程中和iMac与肿瘤细胞共培养过程中各种唾液酸酶受体Siglecs的表达情况,将可能发挥作用的唾液酸酶受体定位在Siglec-1、Siglec-5、Siglec-10和Siglec-15。又进一步通过中和抗体试验定位于Siglec-5和Siglec-10两个唾液酸酶受体。于是,研究团队利用CRISPR-Cas9基因编辑技术在iPSC中同时敲除了Siglec-5和Siglec-10,并通过诱导分化获得Siglec-5和Siglec-10双敲除的CAR-iMac(DKO-CAR-iMac)。后续的实验结果表明,DKO-CAR-iMac具有增强的肿瘤细胞吞噬能力和杀伤能力,显著抑制小鼠体内肿瘤细胞的生长,并延长了小鼠的生存期。DKO-CAR-iMac单独给药的疗效可以达到CAR-iMac与唾液酸酶联用的疗效,而且DKO-CAR-iMac与唾液酸酶联用无法进一步提升其疗效(图4)。
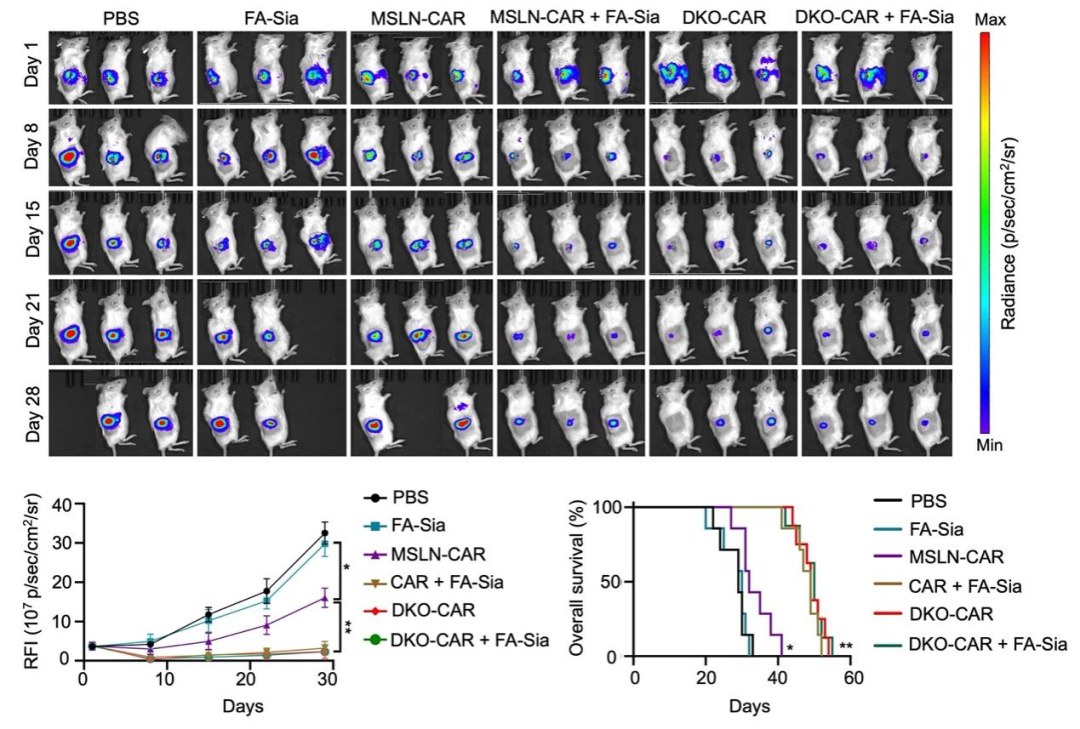 图4.DKO-CAR-iMac具有增强的抗肿瘤疗效
综合来看,该研究发现了肿瘤细胞表面的唾液酸在抗体依赖性细胞吞噬(ADCP)和细胞介导的细胞毒性(ADCC)中的抑制作用,有针对性地清除肿瘤细胞表面的唾液酸显著增强了巨噬细胞对肿瘤细胞的敏感性。此外,以肿瘤靶向分子为载体的唾液酸酶偶联物能够有效且选择性地去除各种肿瘤细胞的不同唾液酸糖链,去唾液酸化增强了CAR-iMac的浸润和激活,并且在卵巢癌和胰腺癌小鼠模型中观察到显著增强的肿瘤抑制能力和显著延长的小鼠生存期。这些效应主要依赖于巨噬细胞表面Siglec-5和Siglec-10免疫检查点的阻断。Siglec-5和Siglec-10双敲的CAR-iMac(DKO-CAR-iMac)也具有显著增强的肿瘤杀伤能力。因此,唾液酸酶联合CAR-iMac,或者敲除CAR-iMac上的免疫检查点是实现巨噬细胞对实体肿瘤高效杀伤的有效方法。
图4.DKO-CAR-iMac具有增强的抗肿瘤疗效
综合来看,该研究发现了肿瘤细胞表面的唾液酸在抗体依赖性细胞吞噬(ADCP)和细胞介导的细胞毒性(ADCC)中的抑制作用,有针对性地清除肿瘤细胞表面的唾液酸显著增强了巨噬细胞对肿瘤细胞的敏感性。此外,以肿瘤靶向分子为载体的唾液酸酶偶联物能够有效且选择性地去除各种肿瘤细胞的不同唾液酸糖链,去唾液酸化增强了CAR-iMac的浸润和激活,并且在卵巢癌和胰腺癌小鼠模型中观察到显著增强的肿瘤抑制能力和显著延长的小鼠生存期。这些效应主要依赖于巨噬细胞表面Siglec-5和Siglec-10免疫检查点的阻断。Siglec-5和Siglec-10双敲的CAR-iMac(DKO-CAR-iMac)也具有显著增强的肿瘤杀伤能力。因此,唾液酸酶联合CAR-iMac,或者敲除CAR-iMac上的免疫检查点是实现巨噬细胞对实体肿瘤高效杀伤的有效方法。
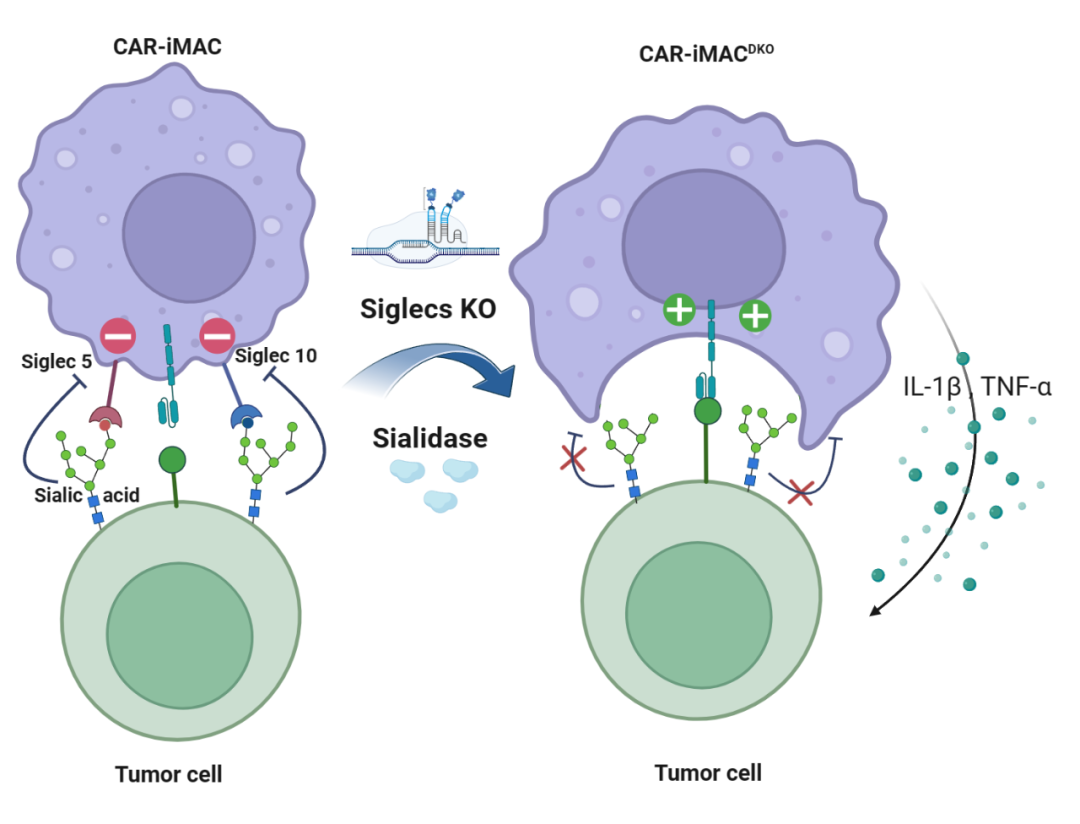 图5.唾液酸酶和DKO-CAR-iMac的作用机制示意图
浙江大学转化医学研究院/医学院附属第二医院的王本教授和良渚实验室/基础医学院/医学院附属第一医院张进研究员是本文的共同通讯作者。王本课题组的2018级博士生伍继成(现武汉大学附属人民医院肿瘤内科医生)、张进课题组的2018级博士生王旭东(已毕业)和王本课题组的2020级硕士生黄裕乔为该论文共同第一作者。其他作者包括王本课题组的张云敬、寿昊、王浩然和张进课题组的苏锶钰都为本研究做出了重要贡献。本研究受到国家重点研发计划、国家和中央高校基本科研经费支持。
版权声明
本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载->
图5.唾液酸酶和DKO-CAR-iMac的作用机制示意图
浙江大学转化医学研究院/医学院附属第二医院的王本教授和良渚实验室/基础医学院/医学院附属第一医院张进研究员是本文的共同通讯作者。王本课题组的2018级博士生伍继成(现武汉大学附属人民医院肿瘤内科医生)、张进课题组的2018级博士生王旭东(已毕业)和王本课题组的2020级硕士生黄裕乔为该论文共同第一作者。其他作者包括王本课题组的张云敬、寿昊、王浩然和张进课题组的苏锶钰都为本研究做出了重要贡献。本研究受到国家重点研发计划、国家和中央高校基本科研经费支持。
版权声明
本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载->
 医药网新闻
医药网新闻

- 相关报道
-
- 上海药物所×临港实验室合作发表Cell论文:基于结构发现新型抗抑郁小分子 (2025-10-26)
- Mol Cancer:阻断甲状腺激素受体为前列腺癌治疗提供了新的途径 (2025-10-26)
- Science子刊:卞修武团队发现增强CAR-T细胞抗肿瘤效果的基因修饰策略 (2025-10-26)
- Nature Biotechnology:直击囊胚“混沌期”——长时程活体成像首次捕捉人类囊胚的染色体分离灾难 (2025-10-26)
- JNCCN:戒烟也应当是癌症治疗的一环!13万名癌症患者数据分析结果显示,癌症确诊后及时戒烟可大幅降低死亡风险,改善手术预后 (2025-10-26)
- NEJM:人工视网膜,帮助老年性黄斑变性患者恢复视力 (2025-10-25)
- 华中师范大学最新Cell子刊论文:开发治疗白血病的多肽类药物 (2025-10-25)
- 《科学》:膳食脂肪重塑昼夜节律!加州大学科学家发现,饮食中不饱和脂肪酸比例会影响昼夜节律,是人体生物钟与季节匹配与否的关键 (2025-10-25)
- 河南中州实验室发表Nature Metabolism论文:揭开大脑髓鞘再生修复的关键 (2025-10-25)
- Nature Medicine:为疲惫的心脏“重启引擎”——基因疗法AB-1002能否逆转心力衰竭的宿命? (2025-10-25)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















