复旦大学程田林/赵兴明团揭示碱基编辑器的遗传毒性并改造优化 |
 |
来源:生物世界 2023-10-20 14:37
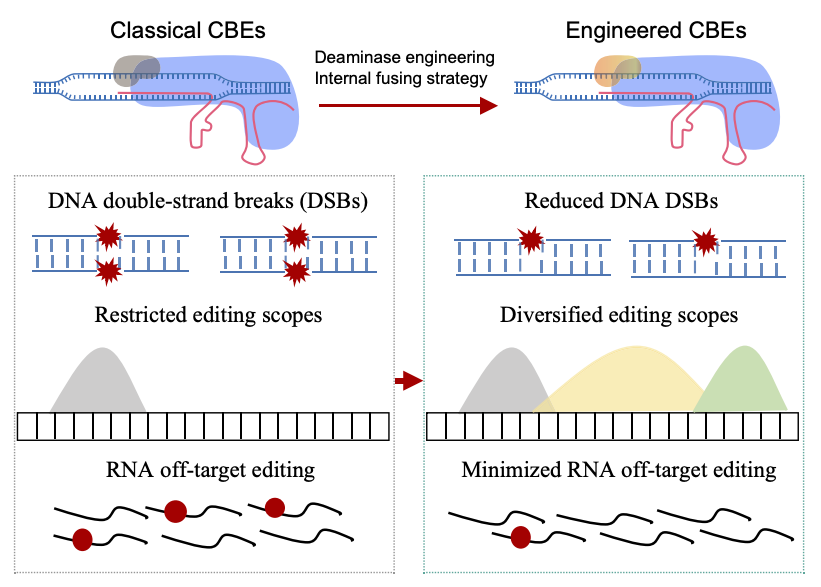
传统认为的高安全性CBEs会显著诱导DNA双链断裂,最终导致安全风险。研究团队进一步通过蛋白质工程改造对多种代表性胞嘧啶脱氨酶进行优化升级,显著降低了CBEs诱导DNA双链断裂的安全风险复旦大学脑科学转化研究院的程田林实验室与复旦大学类脑智能科学与技术研究院赵兴明教授及陈静祺研究员合作,在Nucleic Acids Research期刊发表了题为:Engineering of cytosine base editors with DNA damage minimization and editing scope diversification的研究论文。
该研究指出,除DNA和RNA水平的脱靶风险外,碱基编辑器CBE还会导致明显的DNA双链断裂风险和基因组毒性。研究团队随后通过蛋白质工程改造对两种胞嘧啶脱氨基酶进行系统性优化,并结合nCas9内部融合策略,对CBE的基因组毒性以及DNA和RNA脱靶效应进行了系统性优化,并有效增加了CBE活性窗口的多样性。

研究团队首先对大鼠APOBEC1来源的经典CBE碱基编辑器BE3、BE4和高安全性变体YE1、R33A和R33A-K34A的编辑活性和Cas9非依赖型DNA脱靶效应进行分析比较,证实了YE1的高编辑活性和低Cas9非依赖型DNA脱靶效应。但采用高灵敏性分析工具MuTect2对RNA脱靶效应进行分析时,研究团队发现YE1仍有明显的RNA脱靶风险(C-U突变数量是对照组的2.5倍)。之后研究团队以应用最为广泛的DNA双链断裂标志物 H2AX为基础,通过 H2AX染色和流式分析,对现有CBEs诱导DNA双链断裂的安全风险进行了系统性评估,结果显示包括高安全工具YE1和R33A在内的几乎所有CBEs都会显著诱导DNA双链断裂。最近研究团队和多个实验室指出,通过改造腺嘌呤脱氨酶TadA可构建出新型的TadA-CBEs工具,新工具几乎没有Cas9非依赖型DNA脱靶和RNA脱靶风险。不过研究团队发现,代表性TadA-CBEs工具TadCBEd和CBET1.46仍能显著诱导DNA双链断裂。
综上可知,现有的CBE碱基编辑器几乎都会显著诱导DNA双链断裂,其基因组毒性和遗传毒性不容忽视,因此需要更进一步的优化和改造。
除大鼠APOBEC1外,七鳃鳗来源的胞嘧啶脱氨酶(CDAs)和人源APOBEC3A也是构建CBEs的常用脱氨酶。研究团队首先对不同类型CDAs的编辑活性和Cas9非依赖型DNA脱靶效应进行筛选,发现N-Lj-BE(脱氨酶为LjCDA1)具有高编辑活性和低Cas9非依赖型DNA脱靶效应。已知胞嘧啶脱氨酶的RL1和RL2结构域会调控其结合ssDNA的能力并改变序列偏好性,研究团队用AID/APOBEC蛋白家族的RL1和RL2结构域替换LjCDA1的对应区域并开展后续研究。结果显示,RL1和RL2替换会改变编辑窗口、编辑活性以及序列偏好性,这为差异化CBEs的构建提供了新思路。之后研究团队对LjCDA1来源的CBEs在RNA水平的脱靶效应和诱导DNA双链断裂的风险进行了系统评估,结果显示,LjCDA1来源的CBE几乎没有RNA脱靶风险,且多种突变体诱导DNA双链断裂的风险显著降低。
随后研究团队对人源APOBEC3A进行了系统性的蛋白质工程改造和筛选,发现突变体eA3A-RL1(N57A点突变,RL1区域替换为APOBEC3G的RL1)构建的N-eA3A-RL1-BE具有高编辑活性和低Cas9非依赖型DNA脱靶效应。随后结合团队前期工作即nCas9的内部融合可增强碱基编辑器ABE的编辑活性并拓展活性窗口,研究团队通过内部融合策略构建出一系列eA3A-RL1衍生的CBEs工具,并对其编辑活性、编辑窗口、序列偏好性、Cas9非依赖型DNA脱靶、RNA脱靶以及DNA双链断裂风险进行了系统性评估。研究结果发现,不同的内部融合位点可以增加eA3A-RL1衍生CBEs工具的窗口多样性并改变序列偏好性,但均表现出接近本底的Cas9非依赖型DNA脱靶效应和RNA脱靶效应,且诱导DNA双链断裂的风险显著降低。
碱基编辑器CBE的安全风险及改进
总体而言,该研究发现,传统认为的高安全性CBEs会显著诱导DNA双链断裂,最终导致安全风险。研究团队进一步通过蛋白质工程改造对多种代表性胞嘧啶脱氨酶进行优化升级,显著降低了CBEs诱导DNA双链断裂的安全风险,开发出了高安全性的CBEs新工具,这对碱基编辑器CBEs的临床转化应用有重要的推动作用。
中科院脑科学与智能技术卓越创新中心(神经科学研究所)袁博博士,复旦大学脑科学转化研究院张淑倩博士,复旦大学类脑智能科学与技术研究院宋利婷博士为该论文的共同第一作者。复旦大学脑科学转化研究院程田林青年研究员、赵兴明教授及陈静祺研究员为论文共同通讯作者。复旦大学类脑智能科学与技术研究院曹际新,复旦大学脑科学转化研究院陈金龙博士、邱佳怡对本研究亦有重要贡献。该研究得到了上海交通大学松江研究院仇子龙教授的大力支持。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 德达医疗携手HYROX,科学运动与健康保障同行 (2025-10-27)
- 2025江中医药倒退年夜会举办 16个医药重点名目集中签约 (2025-10-27)
- 第三届中国黄精家当倒退年夜会举办 推进优质中药材出海 (2025-10-27)
- 国度药监局对于复方公英胶囊转换为非处方药的布告 (2025-10-27)
- 海南:“零关税”出口药械政策享惠货值突破3亿元 (2025-10-27)
- Nat Metab揭秘:为什么APOE4基因携带者患老年痴呆症的风险更高? (2025-10-27)
- Science:在大脑中发现了一种新的树突纳米管网络 (2025-10-27)
- 别让孩子输在起跑线上?Clin Epigenet 发现:这条起跑线早在爸爸的精子里,表观遗传密码藏着健康答案 (2025-10-27)
- 终结持续25年的争论!娄智勇/饶子和等团队合作最新Cell (2025-10-26)
- 上海药物所×临港实验室合作发表Cell论文:基于结构发现新型抗抑郁小分子 (2025-10-26)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















