Cancer Res:武汉大学的研究者们揭示了一种增强子在癌症疾病中的作用机制 |
 |
来源:100医药网 2024-03-22 15:00
该研究揭示了BRD4调控转录的KDM5C介导机制,为将BETi纳入与KDM5C抑制剂联合治疗以提高治疗效果提供了理论依据。基因表达程序决定细胞命运,转录失调可导致多种疾病。最近,增强子破坏越来越多地被认为是一种疾病驱动机制,包括人类癌症。转录因子(TFs)、辅助因子和染色质调节因子参与维持增强子的活性状态;然而,调控协调的分子机制在很大程度上仍然不清楚。

图片来源:
近日,来自武汉大学的研究者们在Cancer Res杂志上发表了题为 KDM5C-mediated recruitment of BRD4 to chromatin regulates enhancer activation and BET inhibitor sensitivity 的文章,该研究揭示了BRD4调控转录的KDM5C介导机制,为将BETi纳入与KDM5C抑制剂联合治疗以提高治疗效果提供了理论依据。
BET家族成员BRD4是一种含溴结构域的蛋白,在驱动癌基因表达中起重要作用。鉴于BET抑制剂在各种癌症类型的致癌网络调节中的关键作用,其临床应用一直受到剂量限制性毒性和耐药性的阻碍。了解BRD4活性的机制和识别预测性生物标志物可以促进BETis的成功临床应用。
在这里,研究者发现KDM5C和BRD4协同维持的生长。在机制上,KDM5C与BRD4相互作用并刺激BRD4增强子的募集。此外,BRD4 c -末端与KDM5C的结合刺激了KDM5C的H3K4去甲基化酶活性。kdm5c相关BRD4和h3k4me /3的丰度决定了许多癌基因的转录激活。
值得注意的是,在肿瘤细胞系和患者来源的类器官模型中,KDM5C的耗损或药理降解显著降低了BRD4染色质的富集,并显著提高了BETi在多种癌症类型中的疗效。此外,在异种移植小鼠模型中,靶向KDM5C与BETi联合抑制肿瘤生长。
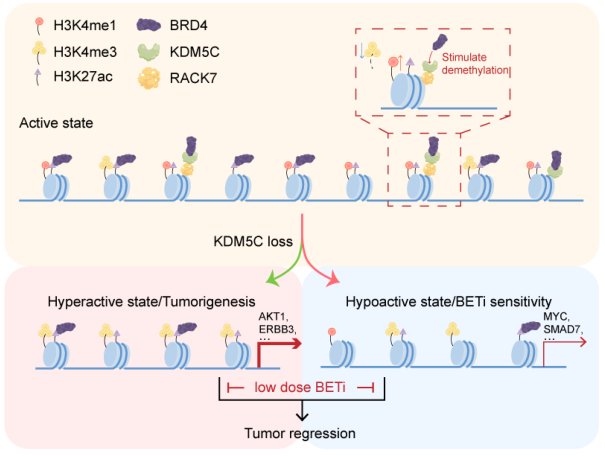
kdm5c介导的BRD4募集和组蛋白去甲基化模型维持增强子的活性状态
图片来源:
总之,本研究证明了KDM5C招募BRD4为活性增强子元件,并表现出更高的组蛋白去甲基化酶活性,以维持活性增强子状态并调节基因表达模式。这些发现为开发新的癌症联合疗法提供了线索。( 100yiyao.com)
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 金赛药业携手全球最大的脱敏治疗药企ALK,有望开启中国脱敏治疗新时代 (2025-09-18)
- Nature Methods:当百年病理学遇见AI——iSCALE赋能H&E图像,预测细胞级空间转录组 (2025-09-18)
- 《健康报》专访上海交通大学医学院海南国际医学中心数智医学研究院院长王慧:人工智能推动健康管理深度重构 (2025-09-18)
- Cell Stem Cell:血癌基因DNMT3A的惊人新角色!科学家解锁造血干细胞长寿的奥秘 (2025-09-18)
- 华人学者发表Nature论文,揭示这种基因突变为何会导致阿尔茨海默病 (2025-09-18)
- 为什么感冒鼻塞时,吃东西会没味道?最新Nat. Commun:原来味道不仅需要味觉,还需要嗅觉! (2025-09-18)
- 《自然·免疫学》:打破传统认知!大坪医院/昆明市延安医院团队从头设计多肽,精准抑制细胞焦亡孔道功能,为炎症治疗开辟新途径 (2025-09-17)
- 流感季不用慌!Sci Adv:“抗体鸡尾酒”抗多种毒株还不怕突变,感染5天给药仍能救命 (2025-09-17)
- 新疆放慢构建当代中药家当系统 (2025-09-17)
- 《免疫》:科学家首次发现,最毒乳腺癌在转移前就拿下了抗癌前哨! (2025-09-17)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















