Science丨麻疹病毒F蛋白中和机制获解析 |
 |

本文所使用的抗体是作者此前已发表的鼠源单克隆抗体,经人源化改造而来【4】,命名为mAb 77。作者首先评估其体外抗病毒活性,测得半数抑制浓度(IC50)为0.034nM,优于F蛋白抑制剂化合物3G及抑制多肽HRC4。大鼠体内攻毒实验显示,mAb 77可以显著降低肺部的病毒滴度。接着,作者利用细胞融合抑制实验,对比抗体与不同种抑制剂的作用效果,分析显示mAb 77不能完全阻止F蛋白的激活,但可以阻止其由发卡中间态向融合后六螺旋束构象的转变,即抗体结合F蛋白的中间态构象。
为确证抗体中和机制,作者开始进行冷冻电镜结构解析。首先在F蛋白中引入两个天然存在的突变E170G与E455G,可使F蛋白胞外段被弗林蛋白酶正确切割,并多数稳定于融合前构象,由此解析出F蛋白胞外段的融合前结构,分辨率2.11 ,发现其与已发表的F蛋白融合前结构高度相似【5】,仅存在微小构象差异。而后作者解析出F与融合抑制多肽(FIP)的复合物结构,发现FIP通过占据F1亚基形成的疏水口袋将F蛋白锁定于融合前构象。接下来,作者解析出mAb 77与融合前构象F蛋白的复合物结构,发现一个F三聚体上结合有三分子Fab 77,抗体表位位于F三聚体的基部,同时位于一个F单体的F1和F2亚基及相邻F单体的F1亚基之上。
抗体主要通过其重链的CDR3、CDR H1、H2及L2参与与F的相互作用,两者间共形成16对氢键及一个盐桥。此外,作者还解析出F胞外段的融合后结构,融合前后结构比较显示,结构域I及F2的N端基本不变,结构域II和III发生数埃位移,构象变化最显著的部分是融合肽及七次重复N端HRN。构象变化过程中mAb 77表位中的3个残基发生显著位移,导致抗体无法结合F蛋白的融合后构象。
介于自然界中存在22种麻疹病毒基因型,作者还比较了不同基因型中mAb 77表位的序列差异,发现大部分残基是保守的,仅两个氨基酸存在变异,对抗体结合影响甚微。利用结构比较、DSF、温度分辨的动态光散射等技术,作者发现mAb 77的结合略微增强融合前F蛋白的稳定性,但可以稳定结合融合中间态的方式轻而易举地抑制融合后的构象解聚。通过对F-抗体复合物的精细二维分类,作者最终找到了抗体结合中间态的复合物结构,从而佐证了上述分析。由此提出抗体中和机制的工作模型:mAb 77通过与融合前F不同单体间的结合稳定锚定其上,在H结合受体引发F构象变化时,融合肽释放,该过程抗体依然结合于F蛋白上并阻止F向融合后构象转变,使其锁定于中间态构象。
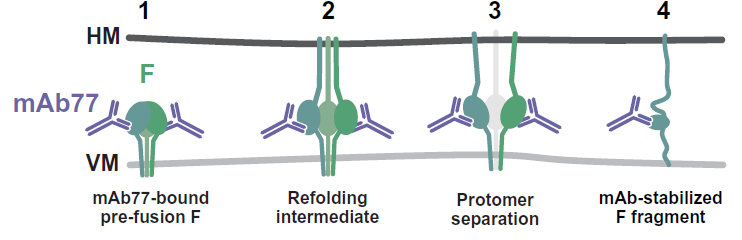
综上,本文解析出麻疹病毒F蛋白的一系列结构,通过生化和结构生物学手段揭示中和抗体mAb 77的作用机制,可为新一代麻疹治疗药物开发提供参考。
医药网新闻
- 相关报道
-
- Immunity:血液中的蛋白质可能有助于预测疟疾的严重程度 (2025-07-30)
- 为什么人类失去了断肢再生的重生能力?最新SCI:部分哺乳动物在进化中被“关闭”Aldh1a2基因开关,无法激活再生程序 (2025-07-30)
- Cell:重磅突破!一针改写大脑 DNA,罕见脑病小鼠迎来生机 (2025-07-30)
- 北京昌平区:打造国内医疗东西城“实验田” (2025-07-30)
- 对于推行下层卫生安康综合实验区第二修改革立异典型教训的关照 (2025-07-30)
- 江西辅助生殖进医保 加重家庭负担超5700万元 (2025-07-30)
- 北京调整规范泌尿体系透析类医疗服务价钱名目 (2025-07-30)
- Nature Biotechnology:AI算法让RNA调控研究“坐上高铁”,一举揭秘4亿年进化路标 (2025-07-30)
- 复旦大学发表癌症方面最新Cell子刊论文 (2025-07-30)
- 国投聚力斥资4.5亿元独家战略投资弈柯莱生物 国家资本重仓生物制造核心赛道 (2025-07-29)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















