Nature:重大进展!揭示FANCD2 |
 |
来源:100医药网 2024-08-12 13:28
这项新的研究表明因DNA交联而停滞的复制叉内的DNA 结构(而不是交联 DNA 本身)触发了D2-I复合物停止滑动并夹紧DNA以启动修复。在一项新的研究中,来自伦敦医学科学实验室和剑桥分子生物学实验室等研究机构的研究人员合作解开了一个数十年之久的谜团,为今后更好地治疗癌症铺平了道路。他们揭示了科学界多年来一直无法理解的一种重要的DNA修复系统 20 多年前发现的范可尼症(Fanconi Anemia, FA)途径,是如何识别DNA损伤并启动修复的基本机制。他们利用最先进的成像技术观察这些DNA修复蛋白如何在单个DNA分子上移动,并利用电子显微镜来捕捉它们如何 锁定 特定的DNA结构,从而为更有效地治疗癌症开辟了道路。
相关研究结果于2024年7月31日在线发表在Nature期刊上,论文标题为 FANCD2 FANCI surveys DNA and recognizes double- to single-stranded junctions 。论文通讯作者为伦敦医学科学实验室的David Rueda教授和剑桥分子生物学实验室的Lori Passmore博士。

DNA 在人的一生中不断受到环境因素的损害,包括阳光中的紫外线、酗酒、吸烟、污染和化学物暴露。DNA 受损的一种方式是发生 交联 ,从而使它无法正常复制和表达基因。为了进行自我复制以及读取和表达基因,DNA 双螺旋的两条链首先必须解链形成单链。当 DNA 发生交联时,两条链上的 核苷酸 就会粘在一起,从而阻止解链。DNA 损伤(包括交联)的累积可导致癌症。FA途径在人的一生中都很活跃,它能识别这些损伤,并不断对其进行修复。
基因突变使得这一途径不那么有效的个体更容易患癌症。虽然参与FA途径的蛋白在很久以前就被发现了,但它们如何识别交联的DNA并启动DNA修复过程仍然是个谜。
研究者此前已发现FANCD2-FANCI(D2-I)蛋白复合物在FA途径的第一步中起作用,它能夹住DNA,从而启动交联DNA的修复过程。然而,关键问题依然存在:D2-I 如何识别交联 DNA,为什么 D2-I 复合物也与其他类型的 DNA 损伤有关?
这项新的研究综合运用了多种前沿的科学技术,证实D2-I复合物沿着双链DNA滑动,监测它的完整性,还优雅地可视化观察了它如何识别在哪里停止,让DNA修复蛋白移动并在发生交联的位点上结合,从而启动DNA修复。
研究者利用一种称为 相关光学镊子和荧光成像(correlated optical tweezers and fluorescence imaging) 的先进显微镜技术,探索D2-I复合物如何沿着双链DNA分子滑动。利用光学镊子,他们可以捕获两个珠子之间的单个DNA分子,这使他们能够精确地操纵DNA并将其与选定的蛋白孵育。
利用荧光标记的D2-I和单分子成像技术,他们观察到单个D2-I复合物如何与DNA结合并沿着DNA滑动,从而实现对DNA双螺旋进行扫描。他们发现D2-I复合物不是直接识别DNA两条链之间的交联,而是在到达DNA单链间隙(一条DNA链发生缺失的区域)时停止滑动。
利用在分子水平上可视化观察蛋白的低温电镜技术,研究者接下来解析出 D2-I 复合物在单链-双链 DNA交叉点滑动和停滞时的结构。他们发现D2-I 与单链-双链 DNA交叉点的接触与它单独与双链 DNA 的接触截然不同。
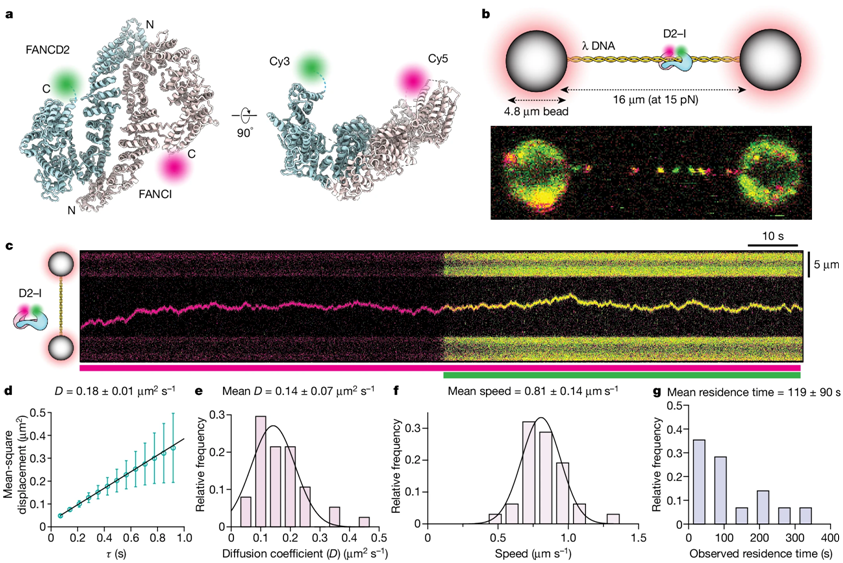
D2-I复合物在DNA上滑动的单分子成像
图片来自Nature, 2024, doi:10.1038/s41586-024-07770-w
这使他们能够确定 FANCD2 蛋白的一个特定部分(称为 KR螺旋 ),他们在单分子成像实验中发现这个部分对于识别DNA单链间隙和在单链 DNA 间隙停滞至关重要。
研究者进一步证实了 D2-I 复合物利用 KR 螺旋在这些交叉点上停滞的能力对于通过 FA 途径修复 DNA 至关重要。
当 DNA 在我们的细胞中正常复制时,它会让两条 DNA 链解链和复制每一条单链。这就形成了一个 复制叉 ,在这个复制叉上,初始的DNA 链被解开,新的双链 DNA 在每条链上形成。但是,当这个复制叉到达 DNA 交联处时,DNA 链就无法解开,从而使通常的 DNA 复制过程停滞。
因此,这个停滞的复制叉包含暴露在外的单链DNA间隙,在这些间隙中,DNA 已经被解开,但却没有被复制。这项新的研究表明D2-I 蛋白复合物紧紧地附着在停滞的复制叉上单链和双链 DNA 之间的这些交叉点上。
这不仅能让 D2-I 复合物将FA 途径中的其他蛋白带到 DNA 交联处启动修复,还能锚定剩余的双链 DNA,保护停滞的复制叉,从而防止细胞中的酶切割 DNA 链的暴露端而进一步损坏 DNA。
这项新的研究表明因DNA交联而停滞的复制叉内的DNA 结构(而不是交联 DNA 本身)触发了D2-I复合物停止滑动并夹紧DNA以启动修复。这些停滞的复制叉出现在许多类型的 DNA 损伤中,这就解释了 D2-I 复合物通过 FA 途径在其他形式的 DNA 修复中发挥着广泛作用。
DNA 损伤是导致多种疾病的关键因素,因此了解 DNA 修复过程,尤其是了解这种修复失败的原因,具有极其重要的意义。至关重要的是,许多物(如顺铂)会对造成严重的细胞损伤,使其停止分裂并死亡。
在这种情况下,DNA 修复途径 这一在正常生命中至关重要的生理过程,可能会被癌细胞劫持,后者利用这些途径抵抗化疗药物的作用。了解了DNA修复途径第一步的机理基础,也许就能找到使患者敏感的方法,从而使抗癌药物在未来更加有效。(100yiyao.com)
参考资料:
Pablo Alc n et al. . Nature, 2024, doi:10.1038/s41586-024-07770-w.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- NEJM:人工视网膜,帮助老年性黄斑变性患者恢复视力 (2025-10-25)
- 华中师范大学最新Cell子刊论文:开发治疗白血病的多肽类药物 (2025-10-25)
- 《科学》:膳食脂肪重塑昼夜节律!加州大学科学家发现,饮食中不饱和脂肪酸比例会影响昼夜节律,是人体生物钟与季节匹配与否的关键 (2025-10-25)
- 河南中州实验室发表Nature Metabolism论文:揭开大脑髓鞘再生修复的关键 (2025-10-25)
- Nature Medicine:为疲惫的心脏“重启引擎”——基因疗法AB-1002能否逆转心力衰竭的宿命? (2025-10-25)
- 槲皮素哪个牌子好?槲皮素品牌前十名:肺结节该怎么选? (2025-10-25)
- 西安多欧信息咨询 :深耕医疗赛道,以全案服务赋能行业创新 (2025-10-24)
- 便秘药物最新推荐 (2025-10-24)
- 叶酸什么牌子口碑最好 (2025-10-24)
- 加科思药业在AACR-NCI-EORTC国际大会公布泛KRAS抑制剂(JAB-23E73)临床前数据 (2025-10-24)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















