Cancer Cell:复旦大学刘杰/骆菲菲团队破解STING激动剂癌症治疗耐药之谜 |
 |
来源:生物世界 2025-03-14 10:10
在这项最新研究中,研究团队发现,STING 信号激活在触发抗肿瘤免疫的同时,还会诱导出高表达 PD-L1 的肿瘤单核细胞。干扰素基因刺激因子(STING)通路在启动针对病原体和肿瘤的反应中发挥着关键作用。STING 信号的激活对于多种癌症疗法的抗肿瘤效果至关重要,STING 激动剂在小鼠模型中治疗不同癌症方面展现出了令人瞩目的潜力。
然而,STING 激动剂单独使用在临床试验中仅显示出极小的疗效,这表明肿瘤对 STING 的单药治疗具有很强的耐药性。阐明其背后的具体机制,对于提高其癌症治疗效果至关重要。
2025 年 3 月 10 日,复旦大学附属华山医院刘杰教授、骆菲菲研究员团队(宋欢、陈琳、潘宣宣为共同第一作者)在Cancer Cell期刊发表了题为:Targeting tumor monocyte-intrinsic PD-L1 by rewiring STING signaling and enhancing STING agonist therapy的研究论文。
该研究揭示了 STING 通路在癌症治疗中的双重作用,解析了STING激动剂通过诱导单核细胞内源性PD-L1介导免疫抑制的全新机制,进而提出了通过重编程 STING 信号提升癌症治疗疗效的新策略,为优化 STING 提供了重要的理论依据和临床前证据。

STING 是启动免疫应答的重要 DNA 传感机制,但靶向 STING 的治疗在临床试验中显示出较差的效果。这里存在着一个矛盾 STING的激活既能引发抗,又能通过上调 PD-L1 等免疫抑制分子来促进肿瘤的免疫逃逸。
在这项最新研究中,研究团队发现,STING 信号激活在触发抗肿瘤免疫的同时,还会诱导出高表达PD-L1 的肿瘤单核细胞(PD-L1hi Tu.Mons),这些细胞在 STING 激动剂治疗的抵抗中占主导地位。研究团队将 STING-IRF3-IFN-I 信号轴诱导的细胞内源性 PD-L1 被确定为促肿瘤的 PD-L1hi Tu.Mons的驱动因素。
值得注意的是,TLR2 激活的 Tu.Mons 细胞能够抵抗 STING 诱导的细胞内源性 PD-L1 的表达上调以及相关的促肿瘤功能。
从机制上讲,TLR2 刺激通过促进 STING 与 TRAF6 的相互作用来重塑 STING 信号转导,从而抑制IRF3-IFN-I 通路,转向 NF- B 激活,进而降低 PD-L1 表达,逆转单核细胞的免疫抑制功能。
最后,研究团队在小鼠模型中证实,将STING 激动剂与TLR2 激动剂预处理相结合,可显著提高抗肿瘤疗效。
该研究的核心发现:
STING 激活诱导的高表达PD-L1 的肿瘤单核细胞(PD-L1hiTu.Mons)主导了对 STING 激动剂治疗的耐药性;
STING-IFN-I 信号轴诱导的细胞内源性 PD-L1 驱动促肿瘤的PD-L1hiTu.Mons;
TLR2 激活会重塑 STING 信号转导,从而降低细胞内源性 PD-L1 表达;
STING 激动剂与 TLR2 预先激活联合使用,显示出增强的抗肿瘤效果。
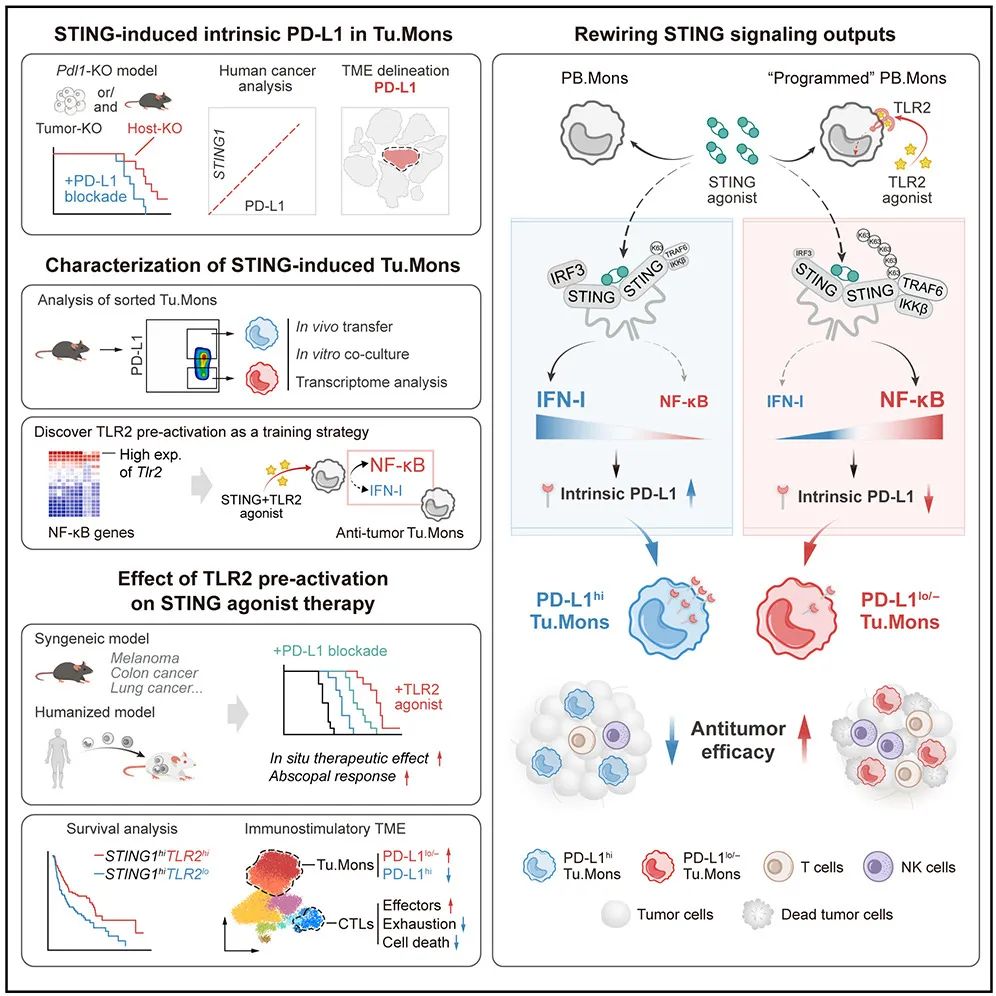
该研究提出了 细胞内源性 PD-L1 的新概念,超越了 PD-1/PD-L1 阻断的传统思路,揭示了 STING 信号输出平衡的调控机制(IRF3 vsNF- B),验证了TLR2 激动剂和STING 激动剂序贯治疗(先 TLR2 激活,后 STING 激动剂)的转化潜力,从而提出了通过微调 STING 信号输出来增强抗肿瘤免疫的有前景的新策略,为优化 STING 靶向治疗提供了重要的理论依据和临床前证据。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Cell:跳舞的蛋白质使细胞运动!新研究重新定义肌动蛋白丝分解的关键因素的功能和作用 (2025-10-29)
- 2 年居家“光声疗法”见效!Alzheimers Dement:40Hz 刺激让晚发性阿尔茨海默病患者 tau 蛋白大降,认知衰退放缓 (2025-10-29)
- Nature子刊新突破!AI驱动HCS-3DX系统实现3D类器官单细胞筛选,重塑药物研发与精准医疗格局 (2025-10-29)
- Nature子刊:局部IL-12递送增强CAR-T细胞在实体肿瘤中的安全性 (2025-10-29)
- Nature子刊:同济大学朱融融/程黎明团队构建新型脊髓类器官,可修复脊髓损伤并恢复运动能力 (2025-10-29)
- 备孕爸爸注意!Nat Commun:父系新冠感染可能会改变精子RNA,并导致后代焦虑风险升高 (2025-10-29)
- 线虫端粒酶 RNA 玩“隐身”!20 年遗传谜题破解:藏进生殖基因内含子“搭车”传后代,抗衰老有新靶点 (2025-10-28)
- 改写遗传学规则!Science:基因的起点和终点并非孤立运作,起点决定终点 (2025-10-28)
- Lancet:不只为减肥!司美格鲁肽护心不靠减重,BMI27也受益,三分之二益处藏着这些关键机制 (2025-10-28)
- CR:压力促进乳腺癌肺转移!同济团队发现,慢性压力可催生特殊助癌中性粒细胞亚型,加速乳腺癌肺转移 (2025-10-28)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















