汪阳明团队创新双组学技术MAPIT-seq:在单细胞水平同时绘制RNA结合蛋白作用图谱与基因表达图谱的新利器 |
 |
汪阳明团队创新双组学技术MAPIT-seq:在单细胞水平同时绘制RNA结合蛋白作用图谱与基因表达图谱的新利器
来源:北大 2025-08-17 14:00
MAPIT-seq在检测互作图谱的同时可以同步获取转录组信息,实现功能结合与表达背景的双重解析。北京大学未来技术学院教授、核糖核酸北京研究中心研究员汪阳明团队在Nature Methods在线发表题为 Co-profiling of in situ RNA-protein interactions and transcriptome in single cells and tissues 的研究论文,报道了团队自主研发的新一代RNA结合蛋白(RBP)研究技术 MAPIT-seq(Modification Added to RBP Interacting Transcript sequencing)。该方法克服了目前RBP-RNA互作技术在实验流程、适用样本和检测分辨率上的局限性,能够应用于微量细胞以及原代组织,兼容高通量单细胞与长读长测序平台,并允许RNA-蛋白互作与转录组同时检测,为深入解析RBP调控机制提供了通用、灵敏和高分辨率的研究工具。
RBP是调控RNA命运与功能的核心因子,广泛参与转录后调控:剪接、稳定性调节、转运和翻译控制等多个生物学过程,在命运决定、神经发育、肿瘤发生等过程中都发挥着关键作用1。深入理解RBP调控网络不仅对基础生物学意义重大,也为提供潜在策略。然而,精确解析快速动态变化的RBP与RNA的结合及其功能效应,仍面临着诸多关键技术障碍。传统方法如CLIP-seq对样本要求起始量大,依赖紫外交联,流程复杂2;而其他前沿方法则面临如通量低、依赖基因改造、无法同时获取转录组信息、缺乏时间/单细胞/异构体分辨率等限制,难以广泛应用于组织样本或临床材料相关的复杂研究中3 5。
针对上述挑战,汪阳明团队创新性地设计并开发了MAPIT-seq技术。该方法通过 抗体定位+RNA编辑 的策略,将体外纯化的protein A/G与两种RNA编辑酶ADAR和APOBEC1的融合蛋白通过特异性抗体招募至目标RBP结合的RNA区域,原位编辑三小时在RBP结合位点附近产生高效且特异的碱基编辑信号,继而通过高通量测序识别RBP-RNA互作事件(图1)。该方法不依赖基因工程操作,适用于固定细胞和冷冻组织,具有通用性强、分辨率高、操作简便等特点。更重要的是,MAPIT-seq在检测互作图谱的同时可以同步获取转录组信息,实现功能结合与表达背景的双重解析。
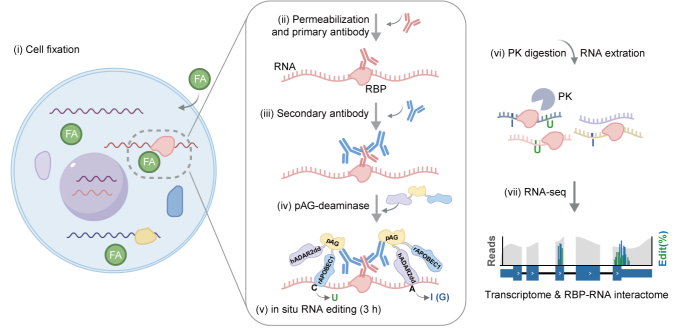
图1MAPIT-seq方法原理图
该研究展示了MAPIT-seq在多种实验场景中的应用。研究人员在模型细胞中展示了MAPIT-seq仅需普通RNA-seq的测序深度即可高效捕获内源RBP互作,验证了其揭示YTHDF2、RBFOX2、PTBP1和PUM1等典型RBP靶标、结合基序与功能模式的可靠性;在小鼠胚胎与胚胎脑组织切片中,MAPIT-seq成功捕获了G3BP1的发育期结合图谱,揭示其在神经系统中的潜在功能;经过测试,MAPIT-seq可以满足500个细胞为起始的RBP结合解析。通过与10X高通量单细胞测序平台结合,MAPIT-seq进一步实现了在单细胞水平同时获取RBP结合图谱和细胞状态信息,揭示了不同细胞周期阶段中RBP结合靶标的动态变化。此外,通过结合长读长测序,MAPIT-seq还实现了对RNA异构体上的结合特异性解析,为理解RBP如何调控特定RNA异构体提供了有力工具。
MAPIT-seq为RBP研究提供了一个强大的 工具箱 ,与不同样本或测序平台结合可以形成三种版本(图2)。其非依赖遗传操作的设计为原代组织与临床样本研究提供了可行路径,单细胞与转录异构体水平的分辨率亦拓展了RBP调控研究的深度与广度,而双组学同时分析的能力更为解析RBP结合的分子层面的功能提供了支撑。未来,团队计划将该方法与空间转录组技术融合,拓展编辑酶工具箱和分析流程,进一步提升其空间和碱基精度,精准绘制组织器官内RBP调控图谱,并推动MAPIT-seq在疾病研究、药物靶点识别及转化医学中的应用。
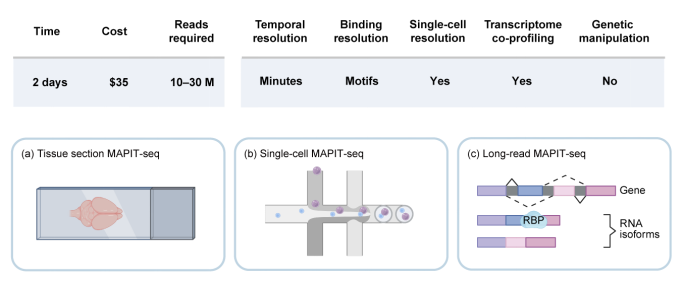
图2 MAPIT-seq方法的特征与应用
北京大学未来技术学院分子医学研究所博士生程玘轩和前沿交叉学科研究院PTN项目博士生谢岗为论文的共同第一作者,汪阳明为通讯作者。北京大学生命科学学院张翔宇、肖俊宇教授为论文作出了重要贡献,前沿交叉学科研究院王杰,未来技术学院分子医学研究所丁双进、吴怡霞、石铭、段菲菲、万子力,中国农业大学生物学院韦竞嘉也为论文工作作出了贡献。本研究获得了国家重点研发计划和的资助支持。
参考文献:
1.Gebauer, F., Schwarzl, T., Valcarcel, J. Hentze, M.W. RNA-binding proteins in human genetic disease. Nat Rev Genet22, 185 198 (2021).
2.Hafner, M. et al. CLIP and complementary methods. Nat. Rev. Methods Primers1, 20 (2021).
3.McMahon, A.C. et al. TRIBE: Hijacking an RNA-Editing Enzyme to Identify Cell-Specific Targets of RNA-Binding Proteins. Cell165, 742 753 (2016).
4.Xiao, Y. et al. Profiling of RNA-binding protein binding sites by in situ reverse transcription-based sequencing. Nat Methods21, 247 258 (2024).
5.Liang, Q. et al. High-sensitivity in situ capture of endogenous RNA-protein interactions in fixed cells and primary tissues.Nat Commun15, 7067 (2024).
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 动辄百万美元奖金,这些科学大奖想要与诺贝尔奖竞争:它们含金量如何? (2025-10-06)
- Nature:T细胞耗竭的悖论——并非“精疲力竭”,而是“生产过剩”引发的蛋白毒性风暴 (2025-10-06)
- Cell:沉默的基因组,喧嚣的转录场——解密结核菌适应性的隐藏驱动力 (2025-10-06)
- Nature:谁掌控了人类生命的第一个开关?一个被“驯化”的逆转录病毒的自白 (2025-10-06)
- 三个月,改写生命!全球首例帕金森病实现功能性治愈 (2025-10-05)
- AJP:迄今最长时间真实世界安全性分析显示,艾司氯胺酮鼻喷剂的安全性与临床研究和产品说明书中已确定的一致 (2025-10-05)
- Nature子刊:谭蔚泓/邱丽萍团队开发核酸适配体武装的单核细胞疗法,治疗阿尔茨海默病 (2025-10-05)
- 多学科合作精准拆弹!仁济医院成功救治白塞病合并胸主动脉瘤破裂出血患者 (2025-10-05)
- Nature:自闭症的“双面人生”——迟来的诊断背后,是另一套基因密码吗? (2025-10-05)
- 中国科学院最新论文登上Cell头条 (2025-10-04)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















