Science:利用开源计算工具预测由蛋白无序区域驱动的分子间相互作用 |
 |
来源:100医药网 2025-09-29 13:39
该工具分析了蛋白质构建单元(称为氨基酸)的化学相互作用,并预测无序蛋白质的哪些部分会对体内的其他分子产生吸引力或排斥力。大多数被深入研究的蛋白质都是折叠的,这意味着它们具有明确的三维形状,这有助于决定每种蛋白质的特定功能。但随着科学工具的进步,人们也认识到,许多重要的蛋白质 或蛋白质的部分 在执行关键的细胞过程时并不保持固定的形状。
这些被称为"固有无序蛋白质"的灵活结构处于持续状态,因此难以研究。虽然诸如获得2024年诺贝尔化学奖的AlphaFold等计算工具对于理解折叠蛋白质的工作原理具有变革性意义,但AlphaFold在研究这些柔性蛋白质方面效果不佳。更好地理解这些变形蛋白质可以识别人类疾病先前未知的原因,并为新疗法提供新思路。

如今,由华盛顿大学医学院生物化学与分子生物物理学助理教授Alex Holehouse领导并发表在《科学》杂志上的一项研究,描述了他的团队开发的一种计算方法,旨在帮助预测固有无序蛋白质的行为。
该工具分析了蛋白质构建单元(称为氨基酸)的化学相互作用,并预测无序蛋白质的哪些部分会对体内的其他分子产生吸引力或排斥力。通过仅基于化学原理进行预测,这种方法使科学家即使在缺乏明确三维结构的情况下也能模拟相互作用。
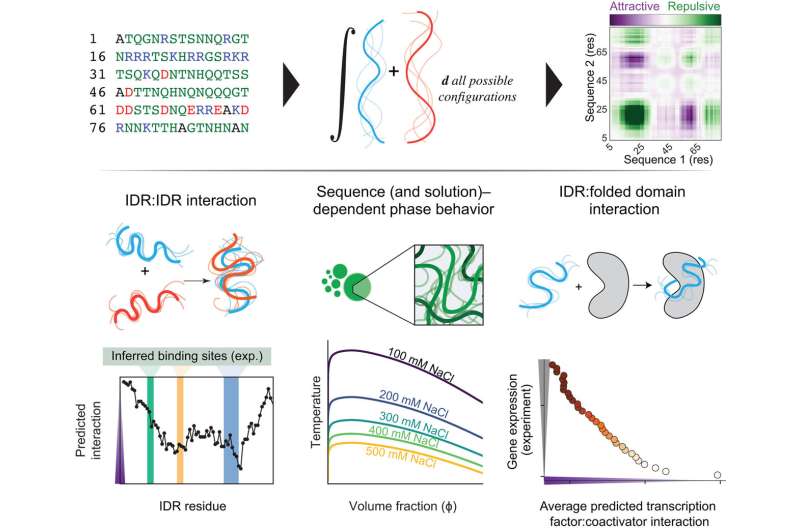
这种方法名为FINCHES,是"通过化学特异性进行第一性原理相互作用(First-principle INteractions via CHEmical Specificity)"的英文首字母缩写。它可以帮助建立关于蛋白质活性和相互作用的分子假说,这些假说随后可以在实验室中进行验证。这意味着研究人员可以开始快速探索无序蛋白质在许多关键生物学背景中可能如何工作,更重要的是,可以探索突变如何在人类疾病(尤其是癌症和神经退行性疾病)的背景下破坏蛋白质功能。
FINCHES是开源工具,研究人员可通过GitHub上的Python软件包或通过网页服务器获取。(100yiyao.com)
参考文献:
Garrett M. Ginell et al, , Science (2025). DOI: 10.1126/science.adq8381.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 颠覆“一胖毁所有”!最新研究:带这种“肥胖基因”缺陷,胖却血脂低、心血管风险降,大脑才是幕后调度官 (2025-10-22)
- Nat Commun:癌细胞也有“作战指挥室”?科学家用纳米炸弹把它炸了! (2025-10-22)
- Cell:黑色素瘤细胞表面的凹陷是肿瘤杀伤热点 (2025-10-22)
- 致敬世界传统医药日,扬子江药业“上新”非遗工艺“中药之冠” (2025-10-22)
- Cell:“细胞风暴”过境,熄灭中枢神经的“燎原之火”——CAR-T疗法为进展性多发性硬化带来新曙光 (2025-10-22)
- Nature Biotechnology:微缩战场!在毫米级芯片上,我们能否洞悉CAR-T细胞与实体瘤的生死对决? (2025-10-22)
- 《自然》:哺乳还有这种好处!科学家发现,生育和哺乳会促进CD8阳性T细胞在乳腺中的积累,可降低乳腺癌风险,尤其是三阴性乳腺癌 (2025-10-22)
- 槲皮素哪个牌子好?2025年十大槲皮素品牌深度解析:肺结节选购指南 (2025-10-22)
- 从结构性洗牌中突围:顾连医疗的十年,与一场康复行业的分化赛跑 (2025-10-22)
- 循证为基,人文为怀:苏州明基医院代谢与减重中心的高质量发展之道 (2025-10-22)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















