JCI:浙江大学柯越海/张雪团队揭示拟素化修饰调控肿瘤免疫逃逸新机制 |
 |
来源:生物世界 2023-01-17 10:14
作为肿瘤免疫微环境的重要塑造者,巨噬细胞通过吞噬肿瘤细胞对免疫监视做出了巨大贡献。巨噬细胞响应促吞噬信号和抗吞噬信号平衡吞噬作用,而肿瘤细胞依赖于对抗吞噬信号分子的表达与继承以逃避免疫监视。目前,通过作为肿瘤微环境的重要塑造者,巨噬细胞通过吞噬肿瘤细胞对免疫监视做出了巨大贡献。巨噬细胞响应促吞噬信号和抗吞噬信号平衡吞噬作用,而肿瘤细胞依赖于对抗吞噬信号分子的表达与继承以逃避免疫监视。目前,通过识别和靶向肿瘤中的吞噬免疫检查点来动员巨噬细胞介导的吞噬作用,已经成为开发疗法的新策略。
新近临床试验已证明联合靶向CD47/SIRP 吞噬检查点可以激活巨噬细胞的吞噬功效从而提高肿瘤治疗收益。肿瘤细胞表面高表达的配体CD47识别并结合髓系抑制性受体SIRP ,通过阻断巨噬细胞伪足形成从而解构吞噬突触。因此探究CD47/SIRP 下游调控细胞骨架重排的机制有助于更好地开发肿瘤靶向疗法。
2023年1月10日,浙江大学基础医学院、医学院附属邵逸夫医院柯越海教授课题组在The Journal of Clinical Investigation期刊发表了题为:SHP2 deneddylation mediates tumor immunosuppression in colon cancer via the CD47/SIRP axis的研究论文。
该研究揭示了一种由蛋白质翻译后修饰拟素化介导的免疫逃逸机制,即拟素化通过影响磷酸酶SHP2的活性从而在肿瘤浸润巨噬细胞中激活CD47/SIRP axis促进肿瘤免疫逃逸,机制上证明了蛋白质去磷酸化及其与其它修饰的互作在免疫逃逸中的重要调控作用,同时基于现有免疫疗法联合靶向抑制SHP2重塑肿瘤微环境实现了对免疫治疗耐受的结肠癌的治疗。

本研究通过临床数据的分析发现,受CD47/SIRP 信号轴调控肿瘤浸润巨噬细胞的是MSS(微卫星稳定)型维持免疫抑制微环境的重要因素。生信分析层面,单细胞RNA测序数据显示:相对其它类型癌症而言,结直肠癌存在特异的SIRP hi肿瘤浸润髓系细胞,并且这些细胞具有更高的拟素化分子转录水平。
质谱流式数据显示阻断CD47/SIRP 信号轴后,结直肠癌浸润巨噬细胞群中底物拟素化修饰谱的变化依赖于去拟素化酶SENP8。MSS型结直肠癌患者的肿瘤浸润巨噬细胞显示出SENP8和免疫抑制的高相关性。
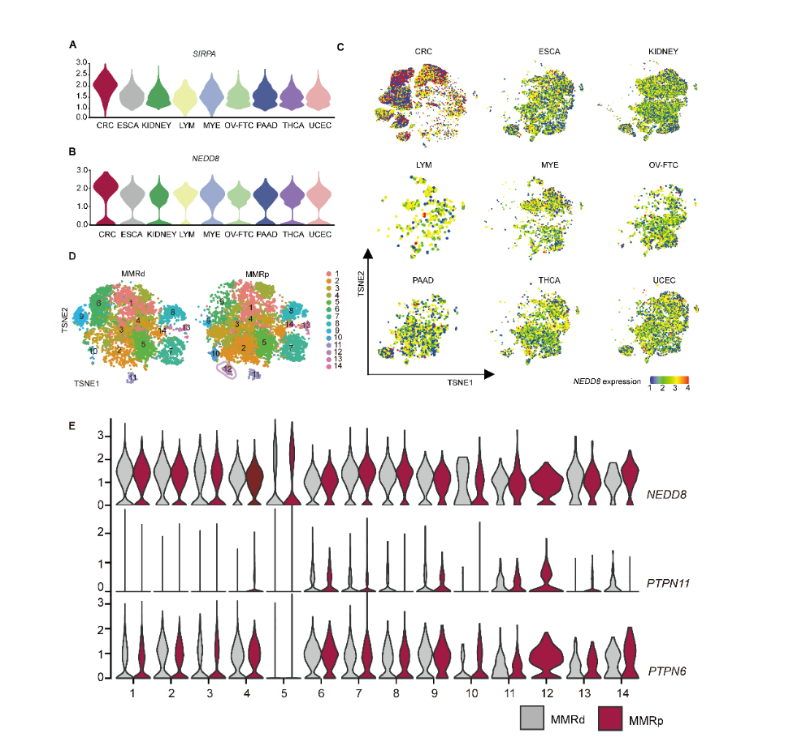
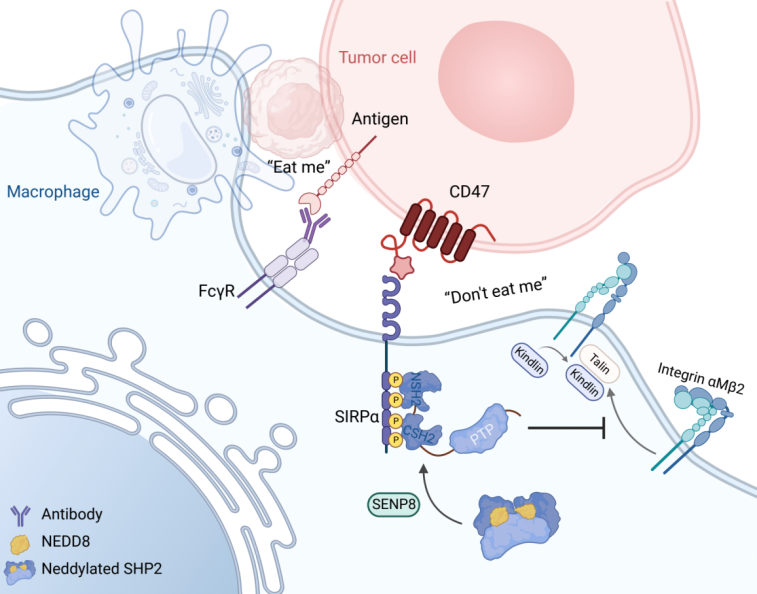 磷酸酶SHP2拟素化调控结直肠癌巨噬细胞免疫逃逸 Don t eat me 的作用机制
目前CodeBreaK 100/101 试验(NCT04185883)正在评估KRAS G12C 突变抑制剂和联合SHP2抑制剂在局部晚期或转移性结直肠癌患者的效用。此研究提供了有关结直肠癌治疗耐药性的详细信息以及潜在的解决方案。
版权声明
本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载->
磷酸酶SHP2拟素化调控结直肠癌巨噬细胞免疫逃逸 Don t eat me 的作用机制
目前CodeBreaK 100/101 试验(NCT04185883)正在评估KRAS G12C 突变抑制剂和联合SHP2抑制剂在局部晚期或转移性结直肠癌患者的效用。此研究提供了有关结直肠癌治疗耐药性的详细信息以及潜在的解决方案。
版权声明
本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载->
 医药网新闻
医药网新闻

- 相关报道
-
- 西藏社保系统完成跨越式倒退 织密高原“平易近生保证网” (2025-10-23)
- 重磅!杭州医保新政宣布!来岁1月1日起施行 (2025-10-23)
- “搞笑诺贝尔奖”研究,再登Cell子刊:人类也可以通过肛门呼吸,关键时刻能救命,已开展人体临床试验 (2025-10-23)
- 反复腹痛腹泻、家族里多人中招?新研究找到溃疡性结肠炎关键基因 OTUD3,从根源修复肠道屏障有戏了! (2025-10-22)
- Cell Rep:肠道菌群竟会“自制快乐素”?两种益生菌联手改善肠易激综合征 (2025-10-22)
- 招聘启事-浙大医学院附属第一医院尹茂鲁课题组 (2025-10-22)
- 从“跟跑”到“领跑” 国产医疗配备“利器”层出 (2025-10-22)
- 人均预期寿命79岁!安康中国建设“成色足” (2025-10-22)
- 《自然》子刊:华西医院大规模队列研究揭示,一些血液生物标志物或可预测抑郁症风险! (2025-10-22)
- 斯蒂瓦那托集团即用型预灌封注射器能够保证获得欧盟医疗器械法规(MDR)要求的公告机构意见,兼顾产品安全性与性能 (2025-10-21)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















