白血病辞别化疗!艾伯维Imbruvica+利妥昔单抗计划进入美国FDA及时审查,一线医治≤70岁患者 |
 |

2019年11月11日讯 /BIOON/ --艾伯维(AbbVie)近日宣告,已向美国食物和药物治理局()提交了一份弥补新药请求(sNDA),将靶向抗癌药Imbruvica(ibrutinib,依鲁替尼)与利妥昔单抗(rituximab)结合用于较年老患者(≤70岁)慢性淋巴细胞(CLL)或小淋巴细胞淋巴瘤(SLL)的一线医治。
该sNDA正在的及时学审查试点项目(Real-Time Oncology Review pilot program)下停止审查,该项目许可在请求人正式提交请求之前审查数据。项目标目标是摸索一个更无效的审查进程,以确保患者能尽快获取平安无效的医治药物,同时坚持审查质量。
假如取得同意,这一里程碑将标记着在6个分歧疾病范畴对Imbruvica的第11次同意。Imbruvica是一种每日口服一次的开创布鲁顿酪氨酸激酶(BTK)克制剂,由艾伯维旗下公司Pharmacyclics与强生旗下杨森生物技巧公司结合开辟和贸易化。
此次提交sNDA基于III期E1912研讨(NCT02048813)的成果。该研讨共评价了529例年纪≤70岁、先前未承受医治的CLL患者。研讨中,这些患者随机分派承受Imbruvica+利妥昔单抗医治计划(n=354)或化学免疫医治计划FCR(氟达拉滨+环磷酰胺+利妥昔单抗,n=175)。次要起点是无停顿生活期(PFS)、主要起点是总生活期(OS)。
成果显示,与FCR医治组比拟,Imbruvica+利妥昔单抗医治组PFS和OS均明显进步。研讨中的平安性数据与Imbruvica已知的平安性特点分歧。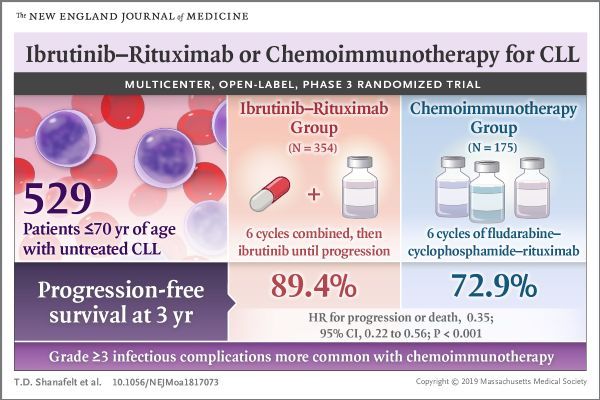
Imbruvica是一种每日口服一次的小分子药物,次要经过阻断癌细胞增殖和转移所需的布鲁顿酪氨酸激酶(BTK)发扬抗癌感化。BTK是B细胞受体旌旗灯号复合物中的一个症结旌旗灯号分子,在恶性B细胞的存活和转移以及其他多种严重致衰性疾病中发扬了主要感化。
Imbruvica可以阻断介导B细胞不受掌握地增殖和分散的旌旗灯号通路,协助杀逝世并下降癌细胞数目,延缓癌症的好转。在中,单药及组合疗法针对普遍类型的血液零碎恶性展示出了弱小的疗效。
自2013年上市以来,Imbruvica在5种B细胞血液癌症以及慢性移植物抗宿主病(cGVHD)在内总共6种疾病范畴取得了10项同意:伴或不伴17p删除渐变(del17p)的慢性淋巴细胞白血病(CLL)、伴或不伴17p删除渐变(del17p)的小淋巴细胞淋巴瘤(SLL)、Waldenstrom巨球卵白血症(WM)、既往已承受医治的套细胞淋巴瘤(MCL)、须要零碎医治而且至多承受过一种抗CD20疗法的边沿区淋巴瘤(MZL)、对一种或多种零碎疗法医治掉败的慢性移植物抗宿主病(cGVHD)。
今朝,艾伯维和强生正在推动一个宏大的Imbruvica临床开辟项目。业界对Imbruvica的贸易远景十分看好。本年6月,医药市场调研机构EvaluatePharma宣布申报:Imbruvica在2018年的全球发卖额为44.54亿美元,而跟着市场的不时浸透及顺应症的不时添加,2024年全球发卖额将到达95.14亿美元。(100医药网100yiyao.com)
原文出处:
医药网新闻
- 相关报道
-
- Cancer Immunol Immunother:当“别吃我”信号遇上“肿瘤GPS”——双功能抗体精准狙击实体瘤,让免疫细胞精准吃掉癌细胞! (2025-06-10)
- Gastroenterology:运动、肠道微生物与胃肠疾病——一场健康的“肠道革命” (2025-06-10)
- 上海交大/清华大学合作开发AI模型,通过视网膜照片预测中风风险 (2025-06-10)
- STTT:AAV基因治疗阿尔茨海默病 (2025-06-09)
- 首款国产冠脉负压机械抽吸导管获批 (2025-06-09)
- 空气污染会诱发早产?!Environ Sci Technol首次揭示PM2.5是如何通过干扰孕妇的新陈代谢增加早产风险 (2025-06-09)
- 十年顽疾终获确诊:上海六院风湿免疫科成功诊治罕见Buschke硬肿病 (2025-06-09)
- Nature:突破性发现,CREM揭示CAR (2025-06-08)
- BMJ:张惠杰团队发表SGLT2抑制剂治疗代谢功能障碍相关性脂肪性肝炎的原创性临床研究成果 (2025-06-08)
- 《自然》:按摩这个位置,加速大脑“排毒”!逆转大脑衰老的新方法来了 (2025-06-08)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















