膀胱癌首创新药!新型ADC药物Padcev获美国FDA加速批准,用于PD |
 |
2019年12月19日/BIOON/--西雅图学公司(Seattle Genetics)与安斯泰来(Astellas)近日联合宣布,美国食品和药物管理局()加速批准抗体药物偶联物(ADC)Padcev(enfortumab vedotin),用于治疗局部晚期或转移性尿路上皮癌(UC,最常见的膀胱癌类型)患者,具体为:既往已接受一种PD-1/L1抑制剂治疗、并且在新辅助/辅助治疗或在局部晚期或转移性疾病治疗中已接受了一种含铂化疗方案的患者。
值得一提的是,Padcev是首个获批治疗UC的ADC药物,也是首个获批用于先前接受过含铂化疗和一种PD-1或PD-L1抑制剂的局部晚期或转移性UC患者的药物。该药通过FDA的优先审查程序获得批准,比原计划提前了3个月。此前,已授予Padcev治疗上述UC患者的突破性药物资格。
Padcev是一种首创的(first-in-class)ADC药物,靶向在膀胱癌中高度表达的一种细胞表面蛋白。该药由靶向连接蛋白-4(Nectin-4)的人IgG1单克隆抗体enfortumab与细胞毒制剂MMAE(monomethyl auristatin E,单甲基奥瑞他汀E,一种微管破坏剂)偶联而成。Nectin-4是一种在包括尿路上皮癌(UC)在内的多种实体中高度表达的治疗靶点。该药中,ADC链接技术来自西雅图学公司,靶点鉴定由安斯泰来完成。
纪念斯隆-凯特琳癌症中心泌尿生殖内科科主任、医学博士Jonathan E.Rosenberg评价称“转移性尿路上皮癌(mUC)是一种侵袭性和破坏性疾病,治疗方案有限,Padcev的批准对于那些在最初治疗失败后选择有限的患者来说是一个重大进步。Padcev纳入了一系列癌症难以治疗的患者,包括那些已经扩散到肝脏的患者,Padcev在这些患者中都表现出了显著的疗效。”
(图片来源-medscape.com)
此次批准,基于关键性II期临床研究EV-201首个队列患者的结果。该队列共入组了125例既往接受过含铂化疗与PD-1/PD-L1抑制剂治疗的局部晚期或转移性UC患者,评估了Padcev的疗效和安全性。
结果显示,Padcev治疗迅速缩小了大多数患者的,客观缓解率为44%(55/125,95%CI:35.1-53.2),完全缓解率为12%(15/125),中位缓解持续时间为7.6个月(范围:0.95-11.3+)。
在所分析的患者亚组中缓解相似,包括预后最差的患者,如既往接受过三种或三种以上疗法的患者、肝转移患者、对PD-1/L1抑制剂无应答的患者。安全性方面,治疗相关不良事件发生在40%的患者中,包括疲劳、脱发、皮疹、食欲下降、味觉变化和周围神经病变。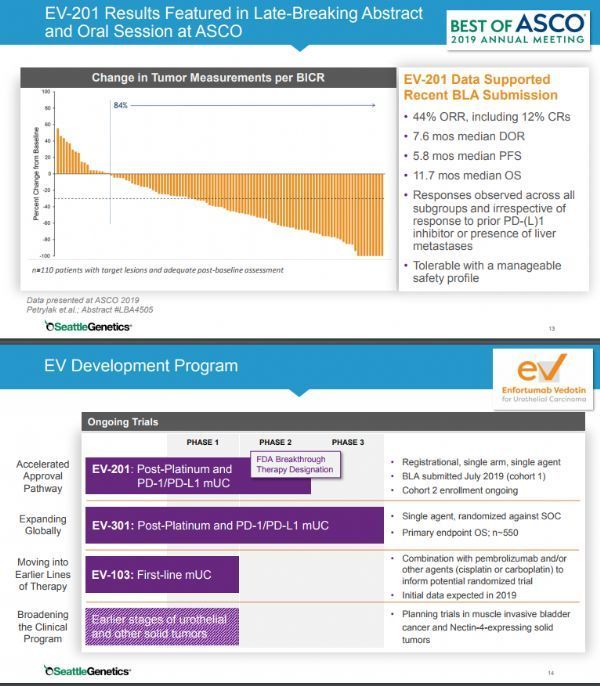
EV-201研究的第二个队列入组的是既往接受过PD-1/PD-L1抑制剂、尚未接受含铂化疗并且不适合顺铂的局部晚期或转移性UC患者,该队列的患者入组工作正在继续进行中。
目前,安斯泰来与西雅图学公司正在开展一项全球随机III期研究(EV-301),旨在支持全球注册。双方也正在开展另一项研究EV-103,评估enfortumab vedotin用于局部晚期或转移性UC患者的更早期治疗,包括联合Keytruda和/或含铂化疗用于新的患者,以及由早期阶段疾病发生癌症进展的患者。
尿路上皮癌(UC)是最常见的膀胱癌类型,约占膀胱癌病例的90%。2018年,美国有超过82000人被诊断为膀胱癌。在全球范围内,去年约54.9万人被为膀胱癌,约20万人死亡。(100医药网100yiyao.com)
原文出处:
医药网新闻
- 相关报道
-
- Cancer Immunol Immunother:当“别吃我”信号遇上“肿瘤GPS”——双功能抗体精准狙击实体瘤,让免疫细胞精准吃掉癌细胞! (2025-06-10)
- Gastroenterology:运动、肠道微生物与胃肠疾病——一场健康的“肠道革命” (2025-06-10)
- 上海交大/清华大学合作开发AI模型,通过视网膜照片预测中风风险 (2025-06-10)
- STTT:AAV基因治疗阿尔茨海默病 (2025-06-09)
- 首款国产冠脉负压机械抽吸导管获批 (2025-06-09)
- 空气污染会诱发早产?!Environ Sci Technol首次揭示PM2.5是如何通过干扰孕妇的新陈代谢增加早产风险 (2025-06-09)
- 十年顽疾终获确诊:上海六院风湿免疫科成功诊治罕见Buschke硬肿病 (2025-06-09)
- Nature:突破性发现,CREM揭示CAR (2025-06-08)
- BMJ:张惠杰团队发表SGLT2抑制剂治疗代谢功能障碍相关性脂肪性肝炎的原创性临床研究成果 (2025-06-08)
- 《自然》:按摩这个位置,加速大脑“排毒”!逆转大脑衰老的新方法来了 (2025-06-08)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















