新冠肺炎最新消息!歌礼制药戈诺卫+利托那韦已治愈3例患者,吉利德瑞德西韦启动多项临床试验! |
 |

2020年02月27日讯 /BIOON/ --歌礼制药近日宣布,由南昌市第九医院陈宏义主任团队发起的口服戈诺卫 (Ganovo ,通用名:达诺瑞韦钠片)联合利托那韦(ritonavir)治疗新型冠状病毒肺炎临床研究:已有3例接受治疗的患者达到国家卫生健康委员会发布的《新型冠状病毒肺炎诊疗方案(试行第六版)》的出院标准后出院,其他入组患者正在治疗中。
该项研究于2020年2月16日获南昌市第九医院伦理委员会批准。第一例确诊的新型冠状病毒肺炎患者已于2020年2月17日入组接受戈诺卫 联合利托那韦治疗。陈宏义是南昌市第九医院感染一科主任,江西省中西医结合学会感染性疾病专业委员会主任委员。
歌礼创始人、董事长兼首席执行官吴劲梓博士表示:“非常高兴,歌礼作为中国抗病毒领域的领军企业,经过多年技术沉淀,由公司研发的抗病毒药物被应用于当前新冠肺炎治疗的临床研究。希望在抗新冠病毒治疗药物的研发和应用方面,歌礼作为中国制药企业贡献更多力量。”
根据中国注册中心(ChiCTR)检索信息显示,该项研究(注册号:)是一项评价戈诺卫联合利托那韦以及中西医结合方案治疗新型冠状病毒感染(COVID-19)患者的疗效及安全性的开放、非随机对照临床研究。研究共设置了5组、每组样本量为10例,分别为:戈诺卫/利托那韦组(戈诺卫/利托那韦口服)、派罗欣组(派罗欣皮下注射)、乐复能组(乐复能肌注+雾化)、克力芝组(克力芝口服)、对照组(中药方剂+短效干扰素雾化)。研究的主要指标是血氧饱和度、次要指标为新型冠状病毒核酸检测。
该项临床研究的药物戈诺卫 是口服丙肝病毒蛋白酶抑制剂,于2018年6月获得国家药品监督管理局批准上市,用于治疗慢性丙型肝炎。戈诺卫 是首个由中国本土企业开发上市的直接抗病毒药物(Direct Acting Anti-viral agent, DAA),获国家十三五科技重大专项“重大新药创制”专项立项支持。利托那韦(ritonavir)则是一种强效HIV蛋白酶抑制剂,可大大降低病毒在体内的复制水平。
英国“自然”杂志(Nature Reviews Drug Discovery)于2020年2月10日发表的文中指出现有的抗艾滋病病毒及丙肝病毒药物有可能对新型冠状病毒有抑制作用。该文章中列出的抗病毒药物,详见补充表格:。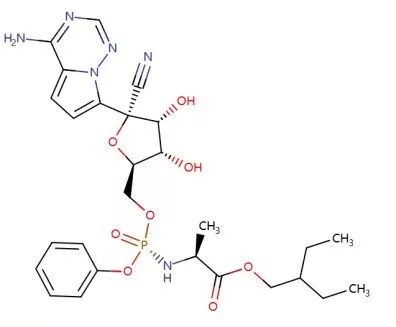
瑞德西韦-remdesivir化学结构式
目前,吉利德抗病毒药物瑞德西韦(remdesvir)是最受关注的一款药物。特别是,本周一,世界卫生组织(WHO)投下信任票,称瑞德西韦可能是治疗新型冠状病毒肺炎(COVID-19)的最佳候选药物(best candidate)。根据报道,本周一(2月24日)WHO新冠肺炎联合专家考察组在北京举行了新闻发布会,WHO助理总干事Bruce Aylward在会上表示:“瑞德西韦是目前我们认为最具疗效的一种药物。”
目前,瑞德西韦正在中国湖北多家医院开展2项III期临床试验(www.clinicaltrials.gov,标识符:NCT04252664,NCT04257656),一项是治疗轻中度COVID-19患者(样本量308例),一项是治疗重症COVID-19患者(样本量452例)。2项试验中,瑞德西韦用药方案相同(静脉注射给药,第1天200mg,其余9天100mg),对照组给予相匹配的安慰剂。
2月25日,美国国立卫生研究院(NIH)宣布,已在内布拉斯加州大学医学中心启动一项随机、安慰剂对照临床试验,评估瑞德西韦治疗COVID-19的疗效和安全性。值得一提的是,这也是美国启动评估药物治疗COVID-19的首个临床试验。该试验首例入组患者为从日本“钻石公主号”游轮上撤侨回国的美国人。试验中,瑞德西韦治疗组给药方案为第1天200mg、其余9天100mg,共治疗10天。
2月26日,吉利德宣布启动2项III期临床试验,分别评估瑞德西韦治疗中度、重度COVID-19成人患者的安全性和有效性。这些随机、开放标签、多中心试验将在主要发布在亚洲国家的医疗中心以及全球其他确诊病例数量众多的国家招募大约1000例患者(中度400例,重度600例),评估静脉注射瑞德西韦2种不同的给药持续时间(5天,10天;第1天200mg,其余天100mg)。
吉利德将提供上述5项临床试验提供瑞德西韦。该公司首席医疗官Merdad Parsey医学博士表示:“公司的主要关注点是迅速确定瑞德西韦作为COVID-19潜在治疗方法的安全性和有效性,此次启动的2项补充性研究将有助于在短时间内为我们提供有关瑞德西韦治疗COVID-19的更宽广的全球数据。瑞德西韦进入COVID-19临床开发的速度反映了当前对有效治疗方案的迫切需要,同时也体现了行业、政府、全球卫生组织和医疗保健提供者以最紧迫的方式应对这一公共卫生威胁的共同承诺。”(100医药网100yiyao.com)
医药网新闻
- 相关报道
-
- Cell Death and Disease:类器官模型揭示 ULBP2 CAR-T 细胞对胃癌的杀伤作用 (2025-08-12)
- Cell子刊:华人团队开发新型微针贴片,促进心肌梗塞后的心脏修复 (2025-08-12)
- 颜宁团队发表最新PNAS论文:助力心脏病及抗癫痫/镇痛药物精准设计 (2025-08-12)
- STTT:湖北工业大学团队发现“癌王”进展新机制和治疗新靶点! (2025-08-12)
- Nature Neuroscience:宋洪军/明国莉/周毅团队揭示人类海马新生未成熟神经元的独特演化规律 (2025-08-12)
- 第十一届马凡病友大会:以爱为翼,让健康与希望接力传递 (2025-08-11)
- Nature子刊:邹强/崔心刚/倪志宇/高强团队发现,饮食来源的半乳糖具有抗癌作用 (2025-08-11)
- 海南封关在即:外泌体产业迎来新机遇 (2025-08-11)
- 激活大脑“清洁工”!Nat Aging:ACE 蛋白让小胶质细胞重获“噬”斑能力,或可逆转阿尔茨海默病? (2025-08-11)
- 数十年前的诺奖级发现,正在挽救这类癌症患者生命 (2025-08-11)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















