研究揭示裂解多糖单加氧酶与底物相互作用机制 |
 |
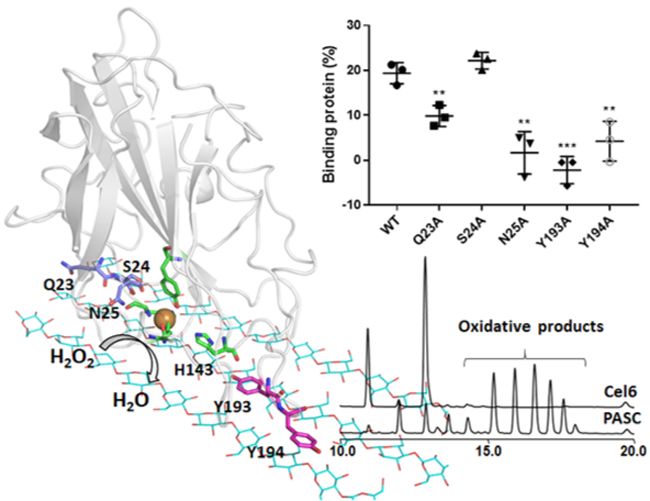
近日,中国科学院大连化学物理研究所天然产物及糖工程研究组研究员尹恒团队与分子反应动力学国家重点实验室分子模拟与设计研究组研究员李国辉团队合作,在裂解多糖单加氧酶(LPMO)与不可溶的纤维素底物相互作用机制方面取得新进展。该研究揭示了LPMO与纤维素底物相互作用的模式,并确定了决定这一过程的关键氨基酸,从而解释了LPMO的底物偏好性和区域选择性。酶与底物的相互作用是揭示酶的催化机理从而指导酶工程改造的重要基础。然而,由于有些酶的底物不可溶,极大地限制了X射线晶体衍射和核磁共振等传统的酶与底物相互作用研究方法的应用。其中LPMO介导的纤维素氧化裂解就是一个例子。LPMO是近年来发现的一大类可以通过氧化的方式破坏纤维素等不溶多糖结晶区的金属酶,它们可以为纤维素水解酶提供更多的作用位点,从而提高纤维素的降解效率。尹恒团队系统开展了LPMO的发掘及活性研究工作,并合作构建了光电驱动-LPMO酶催化系统(l. Catal. B: Environ. ,2020,265: 558;Int. J. Biol. Macromol.,2019,139: 570;Int. J. Biol. Macromol.,2015,79: 72)。但目前人们对于LPMO与纤维素底物相互作用机制了解甚少。针对此问题,研究团队通过计算化学与生物化学相结合的策略,率先揭示了来源于嗜热菌的AA9家族LPMO与纤维素的相互作用模式,发现该酶可以通过同时作用于两条相邻的多糖链,稳定地结合在不可溶的多糖底物的疏水表面,并提出LPMO的区域选择性与其底物结合位置相关。此外,研究团队还建立了此酶促反应过程中过氧化氢的积累与底物结合之间的关系模型,进而证明了LPMO催化不可溶多糖的氧化过程主要是由过氧化氢驱动的。这些发现加深了人们对LPMO与纤维素底物互作机制的认识,为后续酶工程改造及有效利用纤维素等多糖资源提供了理论支持。相关成果发表在《物理化学快报》(The Journal of Physical Chemistry Letters)上。该工作得到国家自然科学基金面上项目、中科院青年创新促进会项目、辽宁省“兴辽英才”项目和大连化物所科研创新基金项目等资助。(100yiyao.com)
医药网新闻

- 相关报道
-
- 2025年度十大护肝片品牌深度横评:哪个牌子效果好又安全? (2025-08-12)
- 护肝片哪个品牌最好最安全?十大护肝片权威榜单测评,科学选择才能护肝不踩坑 (2025-08-12)
- 护肝片哪个牌子效果最好?十大护肝片第一名权威榜单,分辨红黑护肝片产品不走弯路 (2025-08-12)
- 护肝片排行第一名官方旗舰店,护肝片哪个牌子效果最好?第一名实至名归 (2025-08-12)
- 浙江台州药材煎药中心 (2025-08-12)
- 清华大学发表最新Cell论文 (2025-08-12)
- 山东整合医养资本 扩展恒久照顾护士保险服务供应 (2025-08-12)
- 浙江做好恒久照护师学习与职业技巧品级认定任务 (2025-08-12)
- 广西:展开医疗服务价钱规范管理(第五批) (2025-08-12)
- Nature:颠覆认知!V(D)J重组“副产品”,竟能自我复制并引爆白血病复发 (2025-08-12)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















