时隔16年迎来年夜修!生物成品工艺变革迎来新“杀器” |
 |
医药网6月28日讯 料想之中,医药严重政策周五见,为指导MAH有针对性地展开生物成品上市后药学变革研讨,增强生物成品全性命周期治理,确保变革后生物成品的平安性、无效性和质量可控性,2021年6月25日,国度药品监视治理局再缩小招,依据《中华人平易近共和国药品治理法》、《中华人平易近共和国疫苗治理法》、《药品注册治理方法》、《药品临盆监视治理方法》和《药品上市后变革治理方法(试行)》相关规则和要求,CDE官网宣布《已上市生物成品药学变革研讨技术指导准绳(试行)》的告示,自宣布之日(2021年6月25日)起实施,一石激发千层浪,对国际生物医药行业具备深远的意义。
这是自16年前,即2005年的《生物成品临盆工艺进程变革治理技术指导准绳》【国食药监注[2005]493号】宣布以来的初次严重修订,生物成品上市后临盆工艺变革的监管将成生物成品行业洗牌新“杀器”,生物成品平安,关乎平易近生,本文梳理了《已上市生物成品药学变革研讨技术指导准绳(试行)》修订进程中广受社会各界存眷的三个热门。
一、已上市生物成品临盆工艺变革治理痛点
已上市生物成品临盆工艺变革难点是某些企业非法地要下降本钱,监管部分对工艺变革行动短少可执行的指导准绳进行节制,16年前公布的《生物成品临盆工艺进程变革治理技术指导准绳》【国食药监注[2005]493号】分类过于抽象且短少明白的分类准绳,也没有提供具体的材料要求,可执行性不够,不克不及知足现生物成品行业的变革治理需求。
如2018年永生生物疫苗造假案,该企业临盆药品使用的离神思变革未按规则立案及将分歧批次的原液进行勾兑配制,再对勾兑合批后的原液从新假造临盆批号等守法现实,裸露出部门企业存在对变革研讨节制和危险评价治理的看重不够、展开相关研讨不充沛等成绩。
基于上述起因,CDE从全方位欠缺已上市生物成品临盆工艺变革治理为动身点,触类旁通,梗塞破绽,本着鼓舞MAH继续改良工艺,进步和保证生物成品质量的目的,组织修订了《已上市生物成品药学变革研讨技术指导准绳(试行)》。
二、《已上市生物成品药学变革研讨技术指导准绳(试行)》亮点争先看
2.1实用范畴
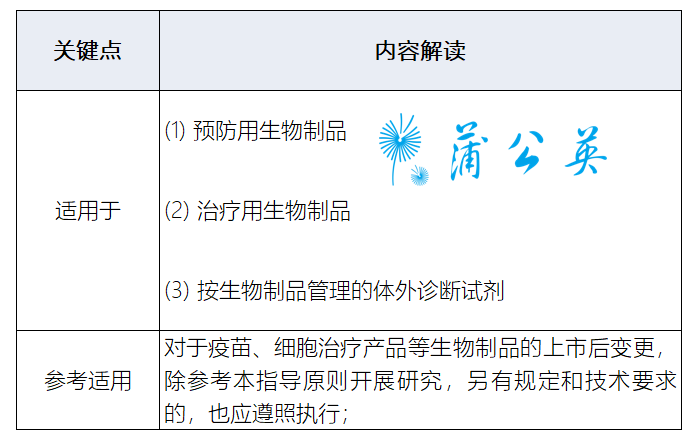
2.2变革分类更迷信
《已上市生物成品药学变革研讨技术指导准绳(试行)》中对各变革事项危险评价分级是在基于迷信和危险的根底上,依照《中华人平易近共和国药品治理法》、《中华人平易近共和国疫苗治理法》、《药品注册治理方法》、《药品临盆监视治理方法》和《药品上市后变革治理方法(试行)》相关规则和要求分为三类,分类的进程中参考了欧美等先进医药机构宣布的相关指导准绳,《已上市生物成品药学变革研讨技术指导准绳(试行)》按药学变革能够对生物成品平安性、无效性和质量可控性的危险和发生影响的水平,履行变革分类。
根据危险和发生影响的水平由高到低分为:严重变革、中等变革、巨大变革。
关于严重变革必要通过系列的研讨证实,该变革纰谬产物的平安性、无效性和质量可控性发生不良影响;关于中等变革必要通过响应的研讨证实,该变革不影响产物的平安性、无效性,而且不下降产物的质量可控性。
需注意的是中等变革曾经勾销征求意见稿中的中等变革A、中等变革B了,而且勾销了三年夜类变革的界说,但2020年04月30日宣布的《已上市生物成品药学变革研讨技术指导准绳》(征求意见稿)的界说可作为变革分类评价的参考根据之一。

三、已上市生物成品药学变革报告材料若何与CTD报告相衔接?
已上市生物成品,当产生药学相关变革时,申办者该当充沛的评价变革关于受试者平安的影响,在变革前应充沛懂得产物的性子,评价变革的危险,充沛相识律例要求,生物成品上市后药学变革因生物成品本身特色分歧,变革事项分歧、变革水平分歧,带来的潜在危险也会有所差异。
笔者建议变革相关报告材料可依照《M4:人用药物注册申请通用技术文档(CTD)》中相关模块要求撰写,为了便于报告,对各项罕见生物成品药学变革事项标注了其所波及的通用技术文件(CommonTechnicalDocument,CTD)章节,以与CTD报告相衔接。这次CDE宣布《已上市生物成品药学变革研讨技术指导准绳(试行)》给出了原液和制剂变革分类,为了不便年夜家查阅。
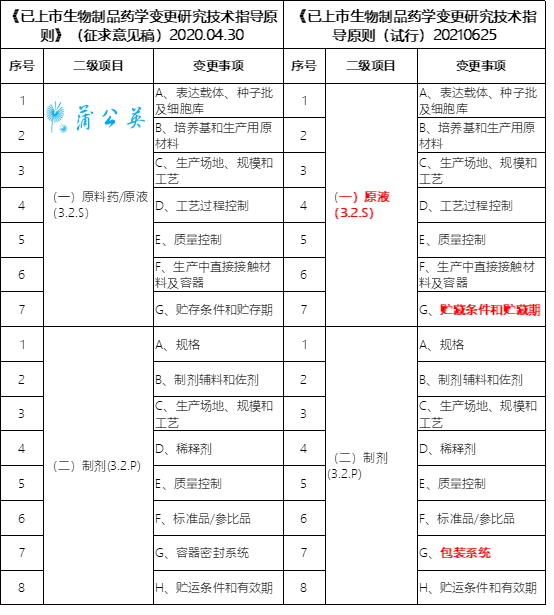
笔者整顿对照了2021年06月25日宣布施行的《已上市生物成品药学变革研讨技术指导准绳(试行)》与2020年04月30日宣布《已上市生物成品药学变革研讨技术指导准绳》(征求意见稿)变革工具的差异,次要差异有三点:
(一)质料药/原液(3.2.S)变革为(一)原液(3.2.S)、原液项下G、储存前提和储存期变革为G、贮藏前提和贮藏期、制剂项下G、容器密封体系变革为G、包装体系,如下表:

- 相关报道
-
- 在家门口享更好医疗服务 城市医疗资本下沉惠及下层庶民 (2025-08-04)
- 国度广电总局部署展开播送电视虚伪鼓吹医药告白集中整治 (2025-08-04)
- 《对于规范医疗机构门诊称号治理任务的关照》政策解读 (2025-08-04)
- 穗港签订单干安顿 推7项动作深入药品监管单干 (2025-08-04)
- 对于展开2025年国度医疗队巡回医疗任务的关照 (2025-08-04)
- 我国中药饮片标注保质期自8月1日起实施 (2025-07-31)
- 河北对于进一步欠缺公立医疗机构特需医疗服务治理的关照 (2025-07-30)
- 江苏对于脑机接口相关医疗服务价钱名目的公示 (2025-07-30)
- 两部分结合部署增强养老服务举措措施规划布局体例任务 (2025-07-29)
- 三部分宣布药用类麻醉 药品和精力药品目次的布告 (2025-07-29)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















