《癌症通讯》:南方医院团队揭示促癌巨噬细胞在肠癌肝转移灶“集结”之谜,有望为肠癌肝转移免疫治疗“破局”! |
 |
《癌症通讯》:南方医院团队揭示促癌巨噬细胞在肠癌肝转移灶“集结”之谜,有望为肠癌肝转移免疫治疗“破局”!
来源:奇点糕 2025-08-02 18:23
研究揭示了一个阻碍CRLM免疫治疗的“幕后黑手”——肿瘤相关巨噬细胞(TAMs)中的鞘氨醇激酶1(SPHK1)。肝脏是远处转移的最主要靶器官,结直肠癌(CRLM)一直是结直肠癌治疗的重点和难点。
近年来,检查点抑制剂(ICIs)为癌症治疗带来突破,可它在CRLM患者中的疗效,却因为肿瘤微环境(TME)的免疫抑制特性而大打折扣[1]。
近期,南方医科大学南方医院方媛、沈智勇的研究团队在Cancer Communications期刊发表的研究成果[2],揭示了一个阻碍CRLM免疫治疗的 幕后黑手 肿瘤相关巨噬细胞(TAMs)中的鞘氨醇激酶1(SPHK1)。谁能想到,这个在鞘脂代谢中起关键作用的激酶,竟然会在CRLM的免疫抑制微环境中扮演如此重要的角色。
这其实是SPHK1+TAMs与结直肠联手制造的阴谋:SPHK1+TAMs通过自身产生的鞘氨醇-1-磷酸(S1P),以自分泌的方式激活NLRP3炎症小体,释放IL-1 ;而IL-1 又会作用于结直肠癌细胞,使其上调单核细胞趋化因子和ADAM17的表达,进而导致更多TAMs浸润,并引发CD8+T细胞,形成一个恶性循环。

论文首页截图
从既往研究来看,SPHK1并非 安分守己 之辈,它在多种癌症的发展过程中都有涉足,比如在瘤中就被发现能通过MTA3-PD-L1轴抑制抗来促进肿瘤生长[3]。研究者们首次将SPHK1与TAMs在CRLM中的免疫抑制作用联系起来,并明确其对免疫治疗效果的影响。
对CRLM患者组织样本的分析显示,SPHK1主要在TAMs中高表达,且SPHK1+TAMs的浸润水平与患者的不良预后以及免疫治疗效果不佳相关。这一现象在动物模型中也得到了验证,敲除SPHK1或使用SPHK1抑制剂后,小鼠肝转移灶的数量和大小明显减少,生存期显著延长,同时TME中TAMs数量明显减少,CD8+T细胞的耗竭状态得到改善,效应功能增强。将TAMs、CD8+T细胞和结直肠癌细胞三者进行共培养,证实了TAMs中SPHK1对CD8+T细胞具有显著的免疫抑制效应。
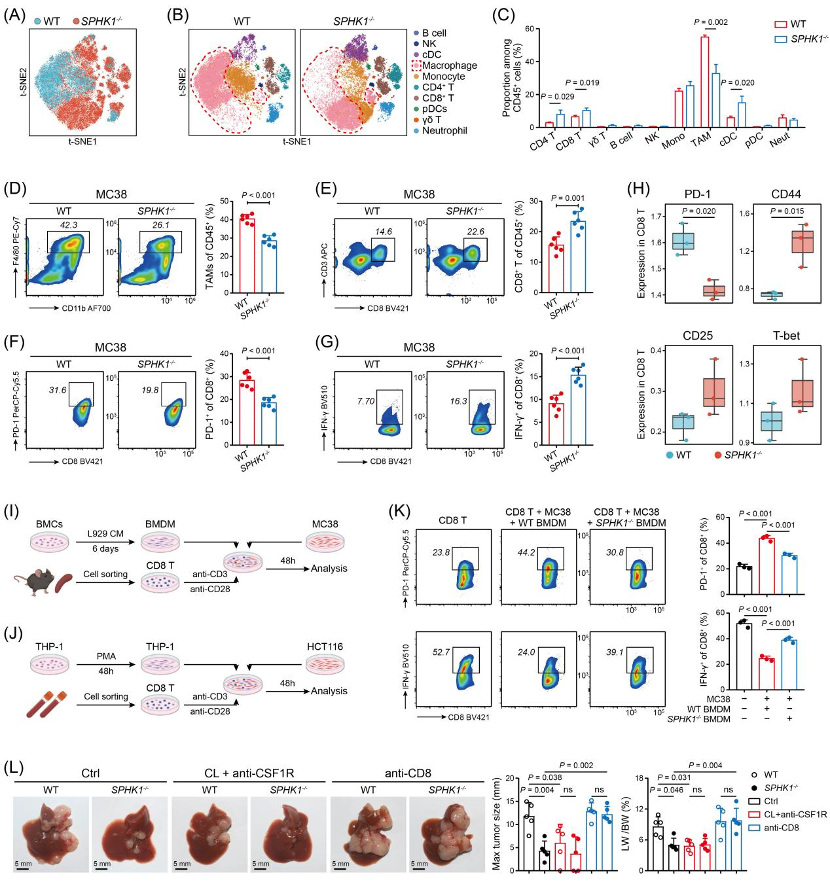
靶向巨噬细胞中的SPHK1可改善CD8+T细胞效应功能,逆转CRLM的免疫抑制性微环境
研究者们进一步发现SPHK1催化产生的S1P与TAMs表面的S1PR2结合,通过激活NF- B和HIF-1 信号通路,促进NLRP3炎症小体的激活和IL-1 的释放。IL-1 一方面会诱导结直肠癌细胞分泌更多的CCL2、CCL7等单核细胞趋化因子,招募更多TAMs到微环境;另一方面会促使结直肠癌细胞释放ADAM17,ADAM17则会导致CD8+T细胞表面CD62L的表达降低,影响其迁移和抗肿瘤活性,并上调PD-1等耗竭标志物的表达。
值得注意的是,当将SPHK1抑制剂与抗PD-1免疫治疗或放免治疗联合使用时,在小鼠模型中取得了更为显著的抗肿瘤效果,不仅肝转移得到有效抑制,小鼠的生存期也进一步延长。这提示SPHK1有望成为预测CRLM患者免疫治疗疗效的生物标志物,而针对SPHK1的治疗策略可能为提高CRLM患者的免疫治疗效果提供新的方向。

靶向SPHK1治疗增强抗PD-1免疫疗法的疗效
总而言之,该研究深入阐明了SPHK1+TAMs在CRLM免疫抑制微环境形成中的核心作用及分子机制,提出了靶向SPHK1与抗PD-1免疫治疗的联合策略,为改善CRLM患者预后提供了极具潜力的新方向。
参考文献:
1.Yu J, Green MD, Li S, Sun Y, Journey SN, Choi JE, et al. Liver metastasis restrains immunotherapy efficacy via macrophage-mediated T cell elimination. Nat Med. 2021;27(1):152-64.
2.Zhan Y, Xu J, Zhang Z, Hu Y, Li Y, Qian J, et al. Targeting SPHK1 in macrophages remodels the tumor microenvironment and enhances anti-PD-1 immunotherapy efficacy in colorectal cancer liver metastasis. Cancer Commun (Lond). 2025.
3.Lau P, Zhang G, Zhao S, Liang L, Zhang H, Zhou G, et al. Sphingosine kinase 1 promotes tumor immune evasion by regulating the MTA3-PD-L1 axis. Cell Mol Immunol. 2022;19(10):1153-67.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 震惊!我国年轻、不吸烟女性肺癌发病率超男性!多项研究:40岁以下、不抽烟女性肺癌率翻倍,特别是东部沿海城市,普遍存在EGFR突变 (2025-10-07)
- Cell:空间组学终极方案?RAEFISH实现单分子与全基因组的“鱼与熊掌兼得” (2025-10-07)
- Nature Medicine:“减肥神药”的另一面:司美格鲁肽如何逆转“脂肪肝”的宿命? (2025-10-07)
- 世界首例!我国科学家创造出通用O型肾脏,并进行了首次人体移植试验 (2025-10-07)
- 研究发现组蛋白甲基转移酶组分的分子机制 (2025-10-06)
- Nature Genetics:陈万泽团队开发单细胞转录因子测序技术,剖析转录因子剂量对细胞重编程异质性的影响 (2025-10-06)
- Cell:“鱼与熊掌兼得”!王思远团队开发单分子分辨率、覆盖全基因组的空间转录组学新技术 (2025-10-05)
- Curr. Biol.:中科院物理所李岩研究组在觅食节律行为的神经机制研究方面取得重要进展 (2025-10-05)
- 水飞蓟宾护肝哪个牌子效果最好?护肝片哪个品牌最好最安全?2025口碑护肝产品公布 (2025-10-05)
- 脂肪肝、酒精肝吃哪种护肝片好?护肝片哪个牌子效果最好?三甲医生联合推荐十大品牌 (2025-10-05)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















