FDA的4款新药来袭 中国市场越发被重视! |
 |
医药网8月4日讯 依据美国食物和药物治理局(FDA)的数据统计,2021年7月FDA共同意4款立异药物,全体为新分子实体。2021年至今,美国FDA已陆续同意了33款立异药物,此中25款为新分子实体,6款为重生物成品,残剩2款为细胞疗法。
近十年FDA同意的新药数目
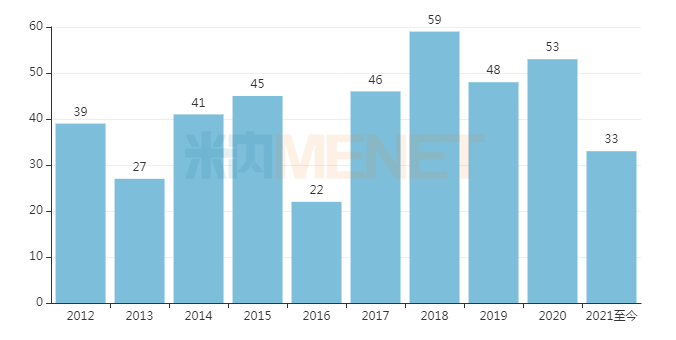
起源:FDA网站、地下材料
2021年7月,美国FDA合计同意的4款立异药物,波及多个疾病畛域,包含首款用于医治糖尿病慢性肾病的非甾体选择性盐皮质激素受体拮抗剂Kerendia(finerenone);首款用于医治布氏冈比亚锥虫惹起的非洲锥虫病的口服药物Fexinidazole(fexinidazole);美国FDA同意的首款也是独一一款ROCK2小分子克制剂Rezurock(belumosudil),以及环球首款得到监管同意医治停顿性家族性肝内胆汁淤积的药物Bylvay(odevixibat)。
7月的4款立异药物中,除了在我国发病率极低的非洲锥虫病的医治药物fexinidazole以外,别的3款新药均已在CDE进行注册报告。此中,finerenone(非奈利酮)曾经处于申请临盆阶段,而belumosudil片由烨辉医药引入,今朝正在进行2期临床实验;Albireo Pharma公司的odevixibat在2020岁终得到了CDE临床实验默示允许。
近年,越来越多的立异原研药放慢进入中国市场的措施,这一方面是由于国度关于立异原研药进入国际是持鼓舞立场的,研发企业可能享用到各类政策盈余;另一方面是跟着国际经济程度不时回升,中国医药市场空间年夜后劲足的劣势越创造显,国外立异原研企业越来越看重中国市场。
FDA同意新药的具体信息
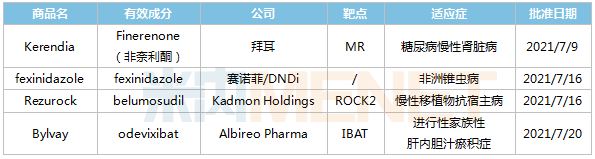
起源:FDA网站、米内网环球药物研发库
Kerendia(finerenone)
2021年7月9日,美国FDA同意了拜耳公司的Kerendia(finerenone,非奈利酮)上市,用于在伴有慢性肾脏病(CKD)的2型糖尿病患者中,下降肾衰竭危险、延缓预算肾小球滤过率(eGFR)的降低速率,下降血汗管灭亡、非致死性心肌堵塞,以及由于心力弱竭住院的危险。Kerendia是首款用于医治糖尿病慢性肾脏病的非甾体选择性盐皮质激素受体(MR)拮抗剂。此前,Kerendia曾得到FDA付与的疾速通道资历认定,这次申请也是通过优先审查路径得到同意。今朝,该药也正在国际承受NMPA的监管审查。
finerenone详细信息
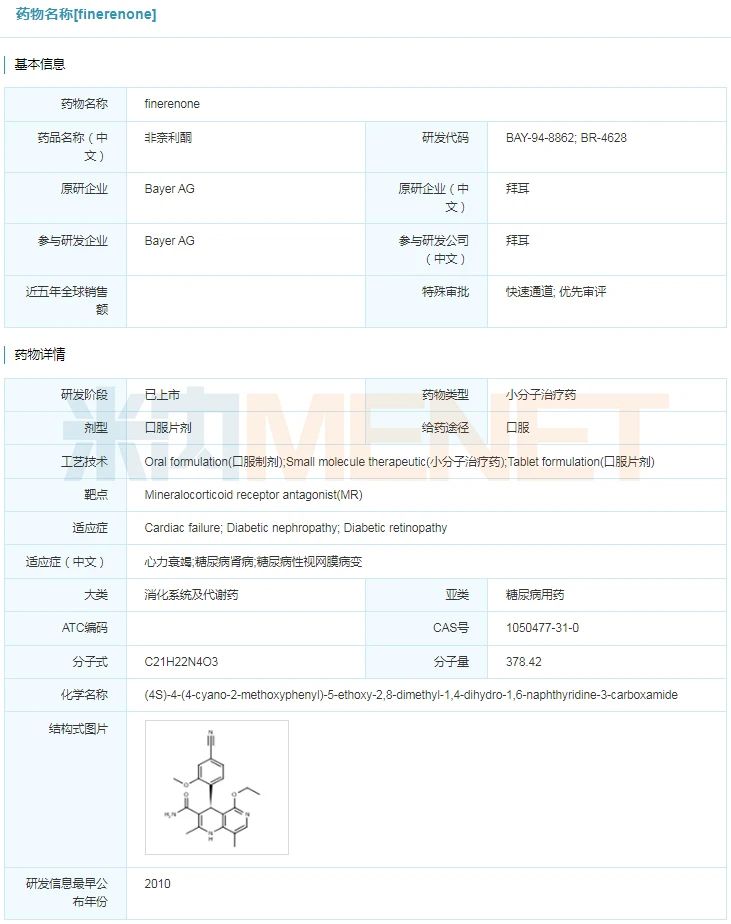
起源:米内网环球药物研发库
在美国,糖尿病是慢性肾病和肾衰竭的次要起因。当肾脏受损而且不克不及正常过滤血液时,就会产生慢性肾脏疾病。因为过滤出缺陷,患者还能够会呈现与体液、电解质和体内废料沉积相关的并发症。慢性肾病有时会倒退为肾功效衰竭,患者也有患心脏病的高危险。在中国,糖尿病慢性肾脏病曾经超过了肾小球肾炎相关慢性肾脏病,成为我国慢性肾脏病的首要病因。
这次同意次要基于名为FIDELIO-DKD的症结性3期临床实验,该实验入组了来自环球48个国度约5700例糖尿病慢性肾脏病的患者。成果显示,与抚慰剂相比,Kerendia将初次呈现肾衰竭危险、延缓预算肾小球滤过率(eGFR)在至多4周内从基线程度继续下降≥40%,肾脏灭亡的复合危险显著下降了18%,血汗管灭亡、非致命性心肌堵塞、非致命性中风或心力弱竭住院光阴的复合危险下降了14%。
Fexinidazole(fexinidazole)
2021年7月16日,赛诺菲和DNDi独特开辟的fexinidazole(fexinidazole)得到美国FDA同意,用于医治布氏冈比亚锥虫惹起的非洲锥虫病(HAT,又称为昏睡病)。fexinidazole是用于昏睡病的首款间接口服医治办法,该药不仅实用于疾病第一阶段,并且实用于寄生虫穿过血脑屏蔽招致患者呈现神经精力症状的疾病第二阶段。此前,fexinidazole已得到美国FDA付与的优先审评和孤儿药资历认定。
fexinidazole详细信息
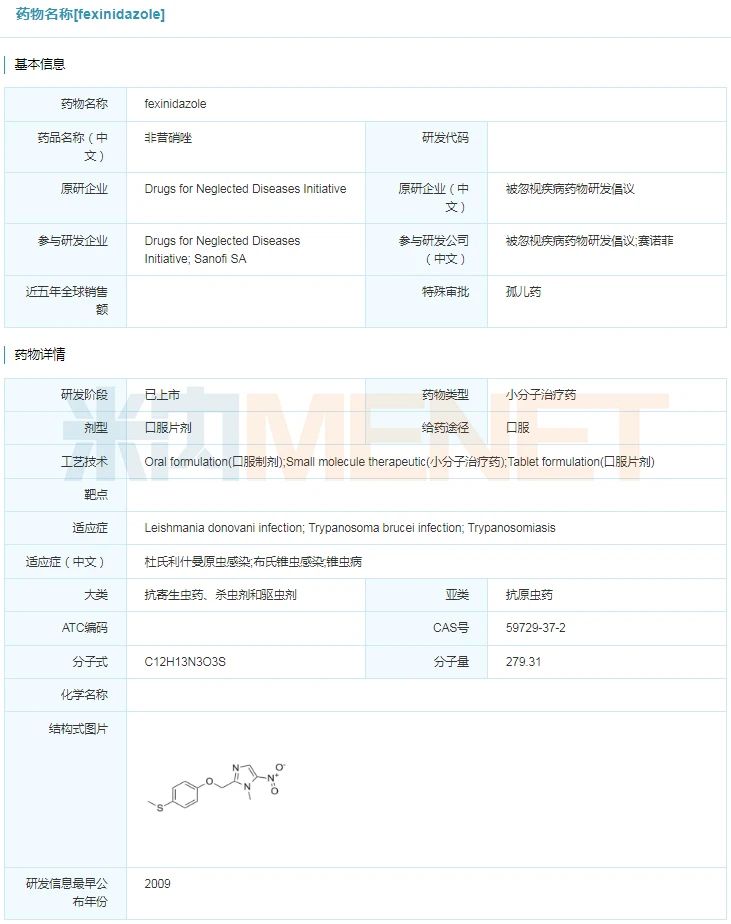
起源:米内网环球药物研发库
非洲锥虫病长短洲人畜共患的重大疾病之一,由受感化的舌蝇(tse-tse fly,采采蝇)叮咬传达,在撒哈拉以南的36个国度风行。此中布氏冈比亚锥虫次要散布于西非和中非,这品种型今朝占非洲锥虫病申报病例的95%以上。患者在最初被叮咬后,锥虫在人体皮下组织中繁衍,而落后入血液和淋巴体系寄生,前期侵入中枢神经体系,患者开端认识丢失,感觉阻碍以及昏睡不醒,就寝周期被完整烦扰,白昼昏睡不醒,早晨却难以入睡。
2012年,DNDi在刚果和中非平易近主共和国的多处,启动了fexinidazole医治昏睡病的症结临床实验,并在2017年实现实验。对200多万人进行昏睡病筛查后,研讨职员们归入了包含晚期和早期两个疾病阶段的749名昏睡病患者,并在成人患者和儿童患者中都验证了该药作为一线疗法的无效性和平安性。
Rezurock(belumosudil)
2021年7月16日,美国FDA发布,同意Kadmon Holdings公司的ROCK2克制剂Rezurock(belumosudil)上市,用于医治先前承受过至多2种体系疗法医治失败的慢性移动物抗宿主病(cGVHD)儿科患者(年龄≥12岁)和成人患者。Rezurock是美国FDA同意的首款也是独一一款ROCK2小分子克制剂。此前,FDA已付与Rezurock突破性药物质格(BTD)和优先审查的资历认定。烨辉医药在2019年已与Kadmon Holdings公司杀青策略单干,得到了belumosudil用于医治移动物抗宿主病在中国临床开辟及贸易化的独家受权。今朝,该药在国际处于2期临床阶段。
belumosudil详细信息
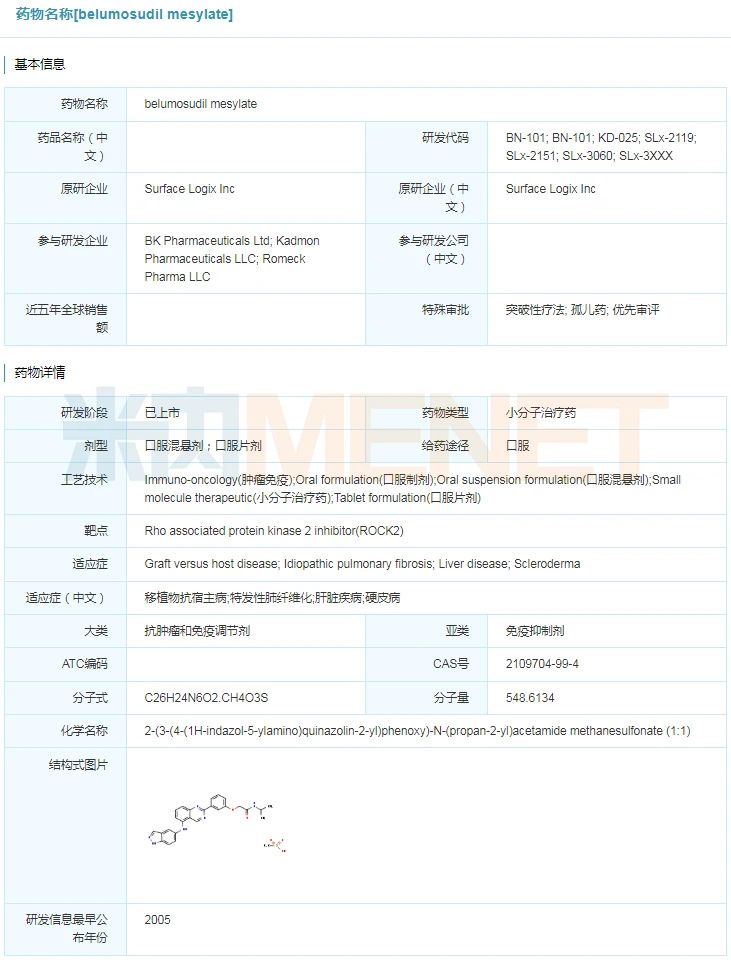
起源:米内网环球药物研发库
异基因造血干细胞移植是今朝医治造血体系恶性肿瘤、某些遗传性及骨髓衰竭性疾病的紧张伎俩,慢性移动物抗宿主病是异基因造血干细胞移植后早期并发症中最为罕见的一种。在异基因造血干细胞移植后存活半年以上的病人中有30%-50%会呈现慢性移动物抗宿主病。它是一种全身性,累及多器官的综合症,相似本身免疫性疾病。
Rezurock在一项随机、开放标签、多中间症结2期临床实验中的良好表示为这次同意奠基根底。名为ROCKstar的临床实验共入组了65名先前已承受过至多2次、最多5次的全身医治失败的慢性移动物抗宿主病患者。研讨成果显示,承受Rezurock医治的患者到达75%的总缓解率(ORR),此中完整缓解率为6%,部门缓解率为69%。中位缓解继续光阴为1.9个月。而初次呈现缓解反馈的中位光阴为1.8个月,62%应对患者在缓解后至多12个月内不必要新的全身性疗法。
Bylvay(odevixibat)
7月20日,Albireo Pharma公司发布美国FDA同意其研发的Bylvay(odevixibat)上市,用于医治一切亚型的停顿性家族性肝内胆汁淤积(PFIC)所惹起皮肤瘙痒。Bylvay是环球首款得到监管同意医治停顿性家族性肝内胆汁淤积的药物。此前,Bylvay已得到FDA付与的孤儿药、疾速通道和优先审评等资历认定。
odevixibat详细信息
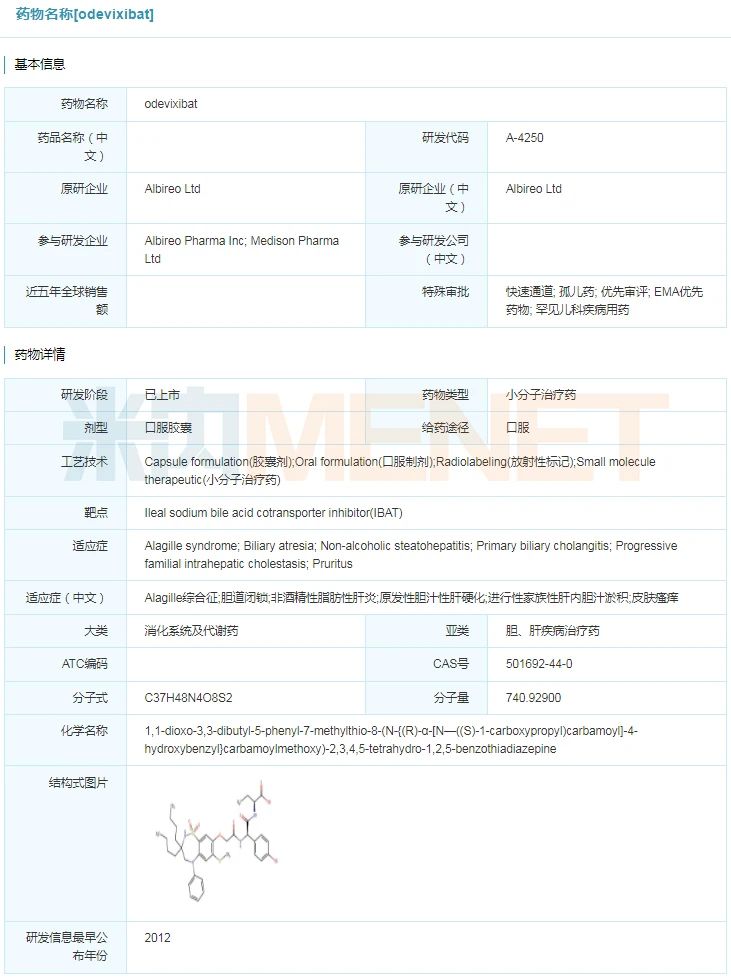
起源:米内网环球药物研发库
停顿性家族性肝内胆汁淤积(PFIC)是一种常见的遗传性疾病,因基因渐变肝细胞难以发生和排泄胆汁,产生肝细胞内胆汁积累,会招致肝细胞毁伤,并能够倒退为更为重大的肝脏疾病。天下范畴内,每5万至10万个重生儿中,约有一个会受PFIC的影响。此前,停顿性家族性肝内胆汁淤积患者的独一选择是肝移植或其他侵入性手术,没有获批的药物可医治PFIC。
Bylvay的平安性和无效性在PEDFIC-1和PEDFIC- 2两项环球性3期临床实验中获得验证。在随机双盲、含抚慰剂对照的PEDFIC-1研讨中, Bylvay医治组显著下降了胆汁酸反馈,显著改善了皮肤瘙痒,且耐受性优越,腹泻/排便频仍的产生率很低。在恒久、开放标签3期扩大研讨PEDFIC-2中,数据重申了Bylvay的微弱疗效,研讨成果显示,在医治长达48周的患者中,胆汁酸反馈继续和耐久地削减、瘙痒评价获得改善、肝脏和成长功效指标令人鼓励。
注:材料起源于FDA官网、企业布告、米内网数据库,若有讹夺,敬请指正。
医药网新闻
- 相关报道
-
- 上海生物医药家当规模预计本年破万亿元 (2025-10-10)
- 国度药监局对于扶正摄生丸转换为非处方药的布告 (2025-10-10)
- 国度金融监管总局宣布推进安康保险高质量倒退的指导意见 (2025-10-09)
- 慢阻肺病归入根本公卫服务落地追踪:“呼吸之痛”若何缓解? (2025-10-09)
- 若何替行为方便白叟用医保开药?国度医保局解答 (2025-10-09)
- 国度医保目次抗癌药品已超230种 (2025-10-09)
- 收益率达8.1% 2024年全国社保基金取得较好投资业绩 (2025-09-30)
- 山东三部分推进药品运营使用环节全种类信息化追溯系统建设 (2025-09-28)
- 国度药监局对于牙膏立案治理无关事项的布告(征求意见稿) (2025-09-28)
- 新疆医疗程度正迈向智能化、精准化新阶段 (2025-09-26)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















