2021年仿制药一致性评价分析报告 |
 |
2015年,国务院发布《关于改革药品医疗器械审评审批制度的意见》,明确指出了提高仿制药质量的目标。近年来,药品监管部门高度重视仿制药质量和疗效的一致性评价(以下简称一致性评价)。过度评价药品的数量和覆盖面大大增加,“跑路”加速。2021年一致性评价工作扎实推进,成效显著。
基于国家美国食品药品监督管理局网站和药品融云数据库的相关数据,对2021年一致性评价进行了分析,发现共有1972个产品规格的仿制药通过了一致性评价(其中895个产品规格的仿制药按照化学新注册分类药品批准),涉及571个医药企业和532个药品品种,其中264个药品品种为首次评价。
补充申请数量逐年降低
企业着力于新注册分类药品申报
通过分析近三年一致性评价补充申请和新注册分类申请的受理情况,发现国家美国食品药品监督管理局药品审评中心2019-2021年一致性评价补充申请和新注册分类申请(仿制药3 /4类和进口药5.2类)呈现完全相反的趋势(详见图1)。补充申请数量持续减少,2021年受理891件,而新注册分类申请数量持续增加,2021年达到18400件。
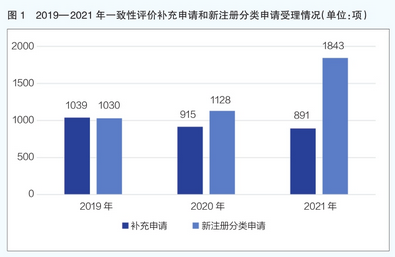
可以看出,仿制药企业的重心开始转移,从关注新注册分类实施前上市药品的一致性评价,转向关注高质量标准的新仿制药研发。
注射剂过评药品占比显著提升行业竞争愈加激烈
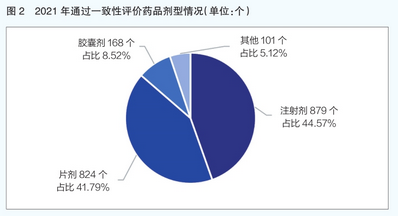
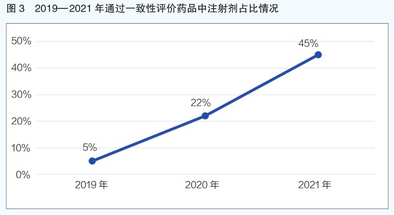
从超评药品剂型来看,注射剂是2021年通过一致性评价药品的主要剂型,共879个规格,占比44.57%;其次是平板电脑,有824个规格,占比41.79%(详见图2)。近三年来,注射剂在审评药物剂型中的占比也呈持续上升趋势,从2019年的5%上升至2021年的近45%(详见图3)。
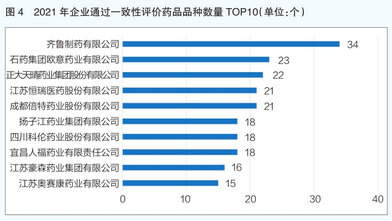
从企业超评情况看,2021年共有571家企业申报药品通过一致性评价,其中齐鲁制药股份有限公司超评药品品种34个(详见图4)。
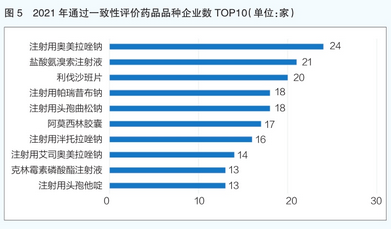
从通过同品种一致性评价的企业数量来看,注射用奥美拉唑钠是2021年通过一致性评价企业数量最多的药品品种,有24家企业的产品通过了一致性评价(详见图5)。该品种为2018年国家基本药物目录品种,2020年国家医保乙类品种。在治疗十二指肠溃疡、胃溃疡、反流性食管炎和zoll l inger-el l ison综合征的过程中,当口服疗法不适合时,它用作替代疗法。注射用奥美拉唑钠临床应用已有20多年,疗效确切,安全性高,市场规模大,药物经济学优势明显,因此该产品被过度评价的企业竞争激烈。
过评药品纳入多批次集采保障人民用药安全性可及性
2016年,《关于开展仿制药质量和疗效一致性评价的意见》明确,对通过一致性评价的药品品种,在医保支付方面给予适当支持,医疗机构优先考虑采购并在临床使用。通过一致性评价的同一品种药品生产企业有3家以上的,在药品集中采购中不再选择未通过一致性评价的品种。此外,2019年发布的《关于国家组织药品集中采购和使用试点扩大区域范围的实施意见》指出,原则上,进入标准的仿制药质量以质量和疗效的一致性评价为依据。一致性评价成为入围仿制药带量采购的基本门槛。
2021年过度评价药品中,共有252个不同规格的药品纳入国家药品集中采购目录,占比12.78%。其中,218种药物的不同特异性
医药网新闻
- 相关报道
-
- 在家门口享更好医疗服务 城市医疗资本下沉惠及下层庶民 (2025-08-04)
- 国度广电总局部署展开播送电视虚伪鼓吹医药告白集中整治 (2025-08-04)
- 《对于规范医疗机构门诊称号治理任务的关照》政策解读 (2025-08-04)
- 穗港签订单干安顿 推7项动作深入药品监管单干 (2025-08-04)
- 对于展开2025年国度医疗队巡回医疗任务的关照 (2025-08-04)
- 我国中药饮片标注保质期自8月1日起实施 (2025-07-31)
- 河北对于进一步欠缺公立医疗机构特需医疗服务治理的关照 (2025-07-30)
- 江苏对于脑机接口相关医疗服务价钱名目的公示 (2025-07-30)
- 两部分结合部署增强养老服务举措措施规划布局体例任务 (2025-07-29)
- 三部分宣布药用类麻醉 药品和精力药品目次的布告 (2025-07-29)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















