浙江大学和药科大学团队发现大肠癌细胞可以“丢弃”抑癌因子 |
 |
来源:奇点蛋糕2022-04-04 10336032
浙江大学张洪河和中国药科大学赖茂德领导的研究团队阐明了circRHOBTB3在大肠癌(CRC)进展中的生物学作用、环化过程和分泌途径。
Circ RNA(circRNA)是一种新的内源性非编码RNA(ncRNA),参与细胞增殖、黏附、凋亡和存活等多种生物学过程[1]。
近年来,circRNAs在癌症领域也获得了越来越多的关注。研究表明,许多circRNAs可以促进细胞周期的发展,抑制或诱导肿瘤细胞的凋亡,抑制肿瘤的形成等[2]。不同的环在肿瘤的发展中起着不同甚至相反的作用。
虽然越来越多的研究报告了异常circrna,和[3],但circrna在肿瘤细胞中的生物学功能、分子机制和环状模式仍不清楚。此外,有研究提出,circRNAs可以通过病理功能未知的外泌体分泌到循环中[4],比线性RNA更容易分选成外泌体。然而,circRNAs的外来体特异性分选机制仍然完全未知。
近日,浙江大学张洪河和中国药科大学赖茂德领导的研究团队,阐明了circRHOBTB3在大肠癌进展中的生物学功能、环化过程和分泌途径。该结果发表在《分子癌症》杂志上。
他们发现,抑制肿瘤的circRHOBTB3由癌细胞通过外泌体分泌,以维持大肠癌细胞的活性。此外,他们设计了针对circRHOBTB3的环状和分泌元件的反义寡核苷酸(ASOs)用于治疗CRC。

报纸首页截图
Circbt3是宿主基因RHOBTB3转录后剪接环化产生的circRNA。RHOBTB3作为Rho GTP酶家族的一种ATP酶,参与膜转运[5,6]和蛋白酶体降解[7]。
先前的研究也表明circRHOBTB3在CRC、HCC和HCC中作为肿瘤抑制因子发挥作用。然而,其循环模式和外泌体分泌途径尚未得到解释。
首先,研究人员分析了来自GEO数据库的12名CRC患者、21名HCC患者、32名胰腺癌(PAAD)患者和14名健康供体的血清外来体的总RNA-seq数据。
结果显示,许多circRNAs在肿瘤患者血清外泌体中有不同程度的表达(图1A),但在三种癌源的所有外泌体中,只有HSA _ CIRC HSA _ CIRC _ 0007444(circRHOBTB3)表达上调(图1B),其宿主基因rhobtb 3在三种肿瘤组织中的表达与正常组织相比无明显增强(图1C)。
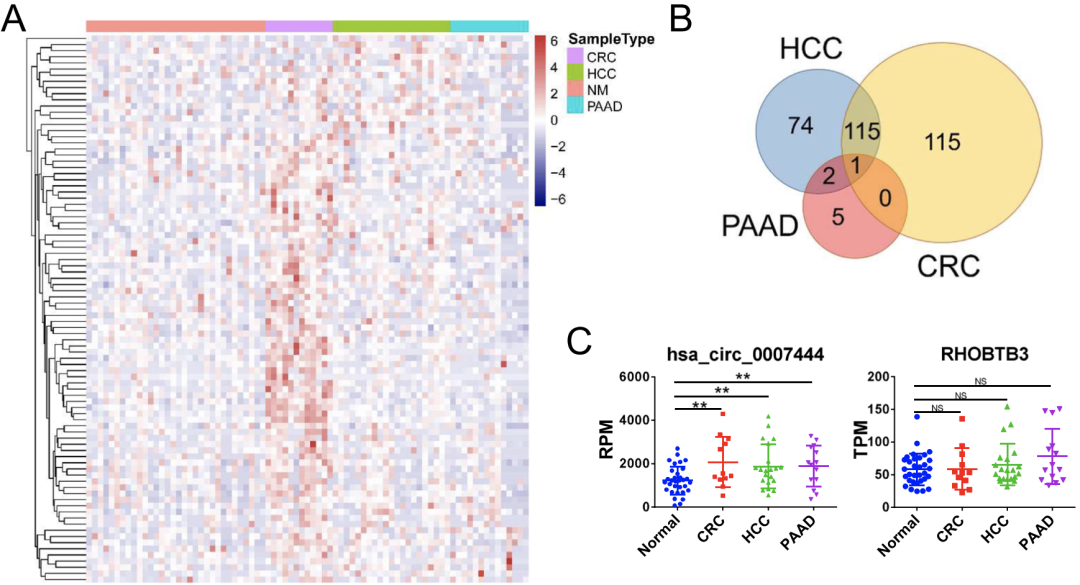
图1 irrchobtb 3在不同类型癌症患者血清外泌体中的表达
然而,对来自浙江大学医学院附属邵逸夫医院的18名CRC患者和16名健康供体的血清样本数据的分析显示,circRHOBTB3在CRC组织中显著下调,而宿主基因RHOBTB3与健康供体相比显著上调(图2中左二)。此外,在69个CRC组织样本中检测到的肝硬化b3的表达显示,肝硬化b3水平较高的患者的总存活时间更好(图2中右起第一个)。
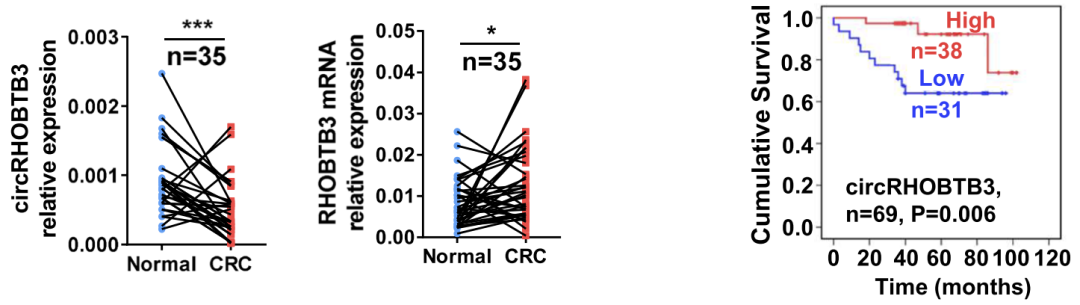
图2大肠癌患者血清外来体中irrhobtb3的表达
所以研究人员不禁假设circRHOBTB3有抗癌作用?
为了验证这一点,他们首先确定了CRC患者血清外来体中的肝硬化b3确实来源于肿瘤细胞而不是基质细胞(图3A),并且在来自NCM460细胞(正常肠上皮细胞系)的外来体中肝硬化b3的水平最低(图3B)。此外,circRHOBTB3在RKO和HCT116细胞(CRC细胞系)中过表达或被敲除。结果表明circRHOBTB3能抑制细胞迁移和侵袭(图3C)。
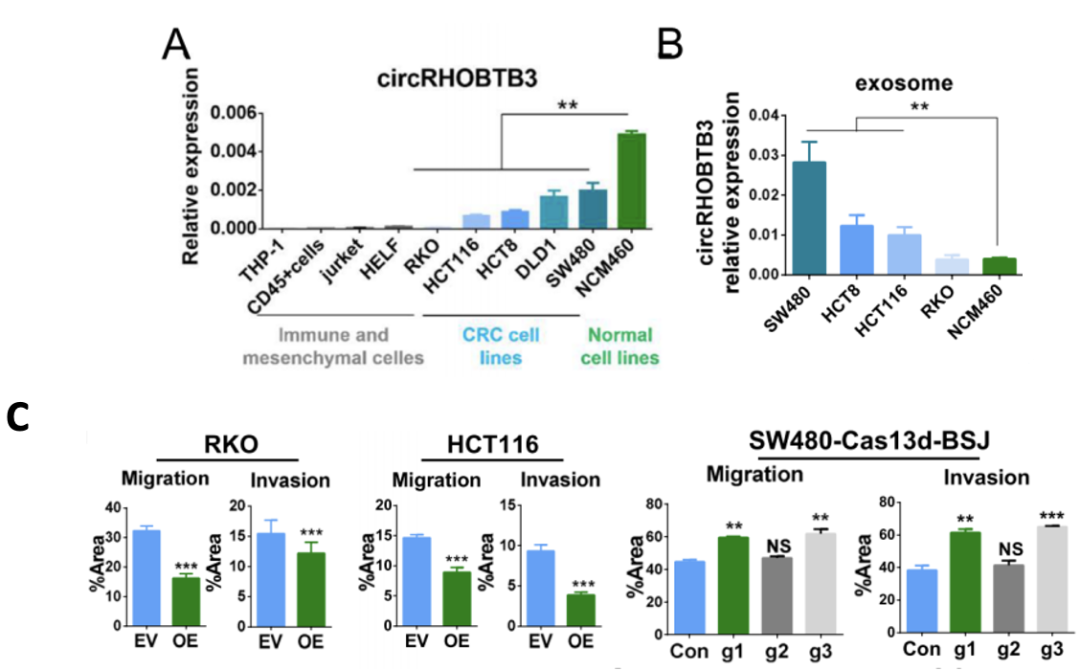
图3 circrhobtb 3来源和功能的体外验证实验
此外,他们通过分析RNA-Seq数据和RT-qPCR验证发现,与代谢、增殖和上皮间质转化(EMT)途径相关的基因在肝硬化btb3敲除/再表达细胞系中显著上调,而肝硬化btb3的再表达降低了这些基因的表达。此外,circRHOBTB3敲除细胞系中的ROS水平也显著增加。
他们还发现circRHOBTB3的结合蛋白是ENO1和ENO2。也就是说,circRHOBTB3可能通过与ENO1、ENO2等代谢酶相互作用,调节细胞内ROS水平,抑制肿瘤细胞增殖和EMT。
为了在体内验证肝硬化b3的功能,研究人员将过表达肝硬化b3的HCT116细胞(CRC细胞系)注射到裸鼠皮下,建立了异种移植瘤模型。发现与不表达肝硬化b3的对照(EV)组相比,肝硬化b3过表达(circhrohbtb 3-OE)组的肿瘤体积和重量明显更小,细胞增殖能力更弱(图4A,b,c)。
然而,当他们在裸鼠的脾脏接种实验中观察肝转移表型时,发现circRHOBTB3-OE组的肝转移少于EV组(图4D,E)。更有趣的是,在异种移植小鼠的血浆和尿液中可以检测到circRHOBTB3,而在野生型小鼠的血浆和尿液中却检测不到。此外,circRHOBTb3-OE组血浆中的肝硬化B3水平高于EV组(图4F,G)。
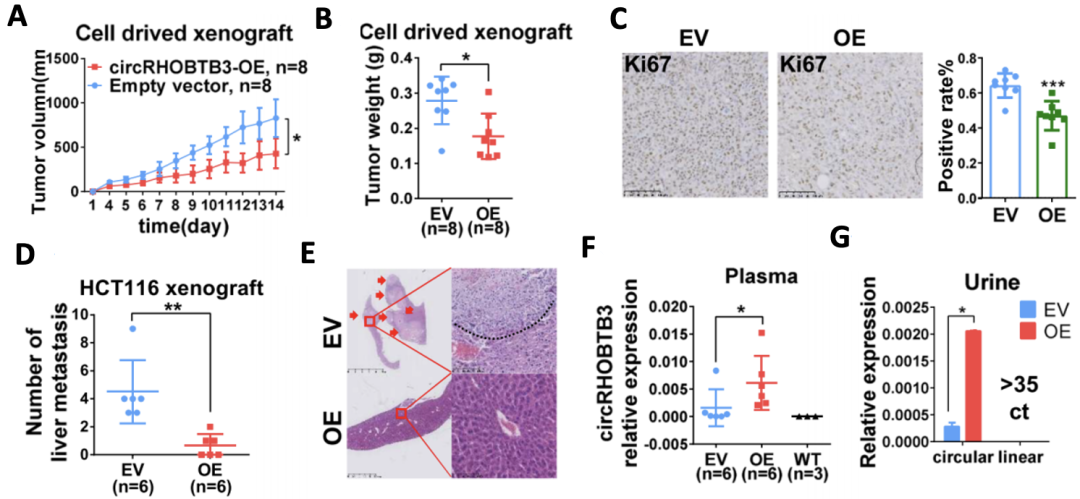
图4 circrhobtb 3功能的体内验证实验
根据这些数据,研究人员推测CRC细胞必须通过外泌体分泌circRHOBTB3来维持肿瘤侵袭转移的特性。换句话说,CRC细胞具有特殊的解毒机制。
在随后的研究中,研究人员发现了肝硬化b3的环化机制,还发现肝硬化b3本身的顺式元件(141 240nt,141-165nt,216-240nt)可以通过外泌体调节肝硬化b3的分泌过程(图5)。
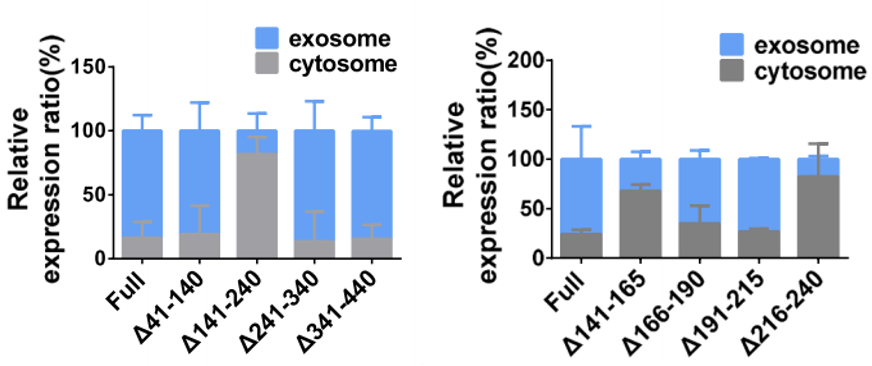
图5用截短的circRHOBTB3载体转染的细胞中circRHOBTB3外来体的分泌丰度
之前的研究发现,ESCRT-II亚复合物作为一种RNA结合复合物,可以将RNA分选成外来体[8]。在这项研究中,他们发现SNF8可以结合到肝硬化b3的141-240nt区域,并促进肝硬化b3分选到外泌体中并分泌到细胞外。他们将这一过程定义为肿瘤外来体的逃逸机制(图6)。

图6 SNF8敲除实验和外源性RIP实验
受上述研究结果的启发,研究人员设计了第二代ASOs,增加circRHOBTB3的环化,减少分泌,有望成为一种新的癌症治疗策略。
研究人员设计了三种第二代ASOs:一种靶向负性环化的元件(ASO-CIR: 266-290NT)和两种外泌体分泌型元件(ASO-EXO1: 141-165NT,ASO-EXO2: 216-240NT)(图7)。
通过实验,他们发现ASO-cir确实可以增加肝硬化b3的环化,但是肝硬化b3的分泌也会增加。在ASO-exo1和ASO-exo2中,只有ASO-exo2(以下简称aso-exo2)不仅增加了circRHOBTB3的细胞内水平,而且阻断了circRHOBTB3外泌体的分泌。因此,研究人员考虑进一步利用ASO-cir和ASO-exo研究其联合治疗结直肠癌的特异性和抗肿瘤效果。
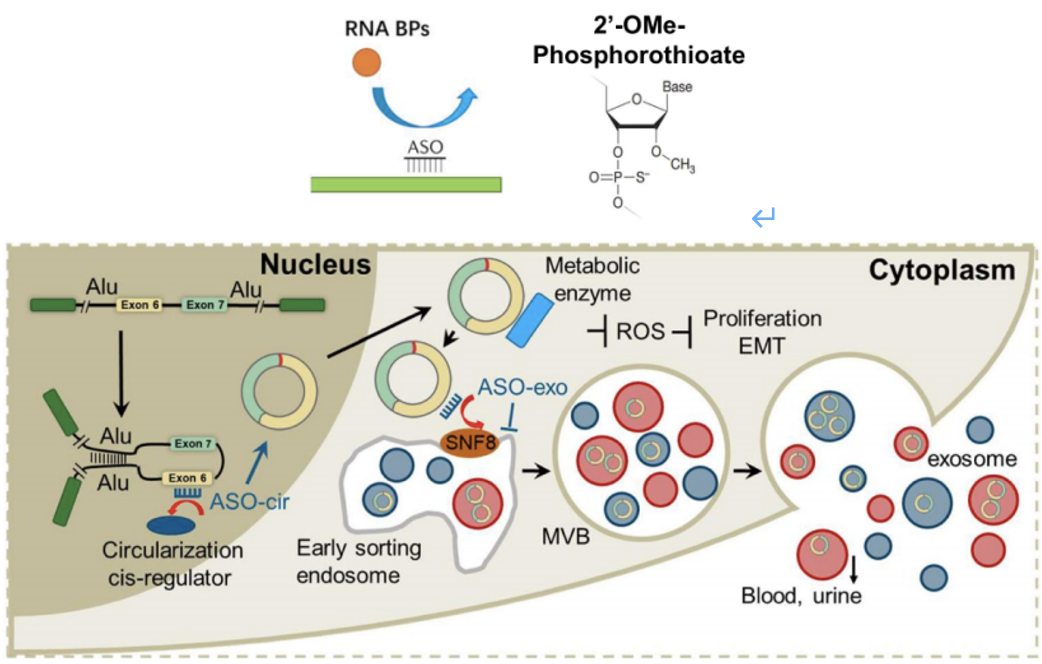
图7第二代ASOs及其作用机理
研究人员验证了ASOs联合确实可以比ASO-cir和ASO-exo单独使用产生更多的细胞内肝硬化b3,小鼠实验结果也符合预期:ASO-cir联合ASO-exo确实可以显著增加肝硬化b3在原发性脾脏病变中的表达,显著降低肿瘤的恶病质,控制转移(图8)。
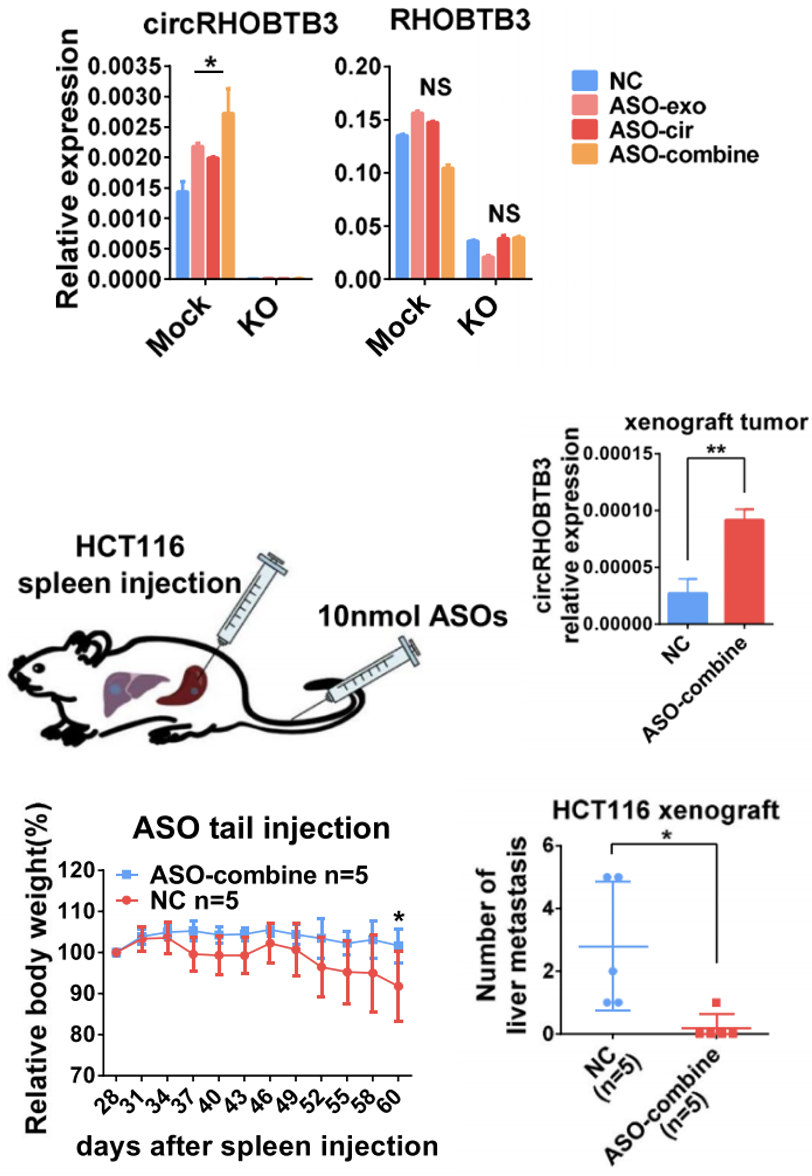
图8体外和体内ASOs实验
总的来说,研究结果阐明了circRHOBTB3调节细胞内ROS和代谢途径抑制CRC进展的机制,也提出了新的肿瘤逃逸理论,即肿瘤细胞通过分泌抑制肿瘤的circRNA(肿瘤外泌体逃逸机制)维持癌细胞的活性。
更重要的是,他们设计的第二代ASOs可以通过靶向环化和分泌来调节肿瘤抑制circRNA,从而促进癌症的治疗效果。他们的临床数据显示,在结直肠癌患者中,85.7%(30/35)的肿瘤样本携带的肝硬化b3水平低于匹配的正常样本,并且肝硬化b3在肿瘤样本中的低表达与不良预后有关。这使我们相信,这种ASOs将成为未来大肠癌的一种有前途的治疗策略。
推荐2022(第六届)细胞外囊泡前沿与转化会议
http://meeting.bioon.com/2022Exosomes/intro
版权声明
本网站所有标注“来源:100医学网”或“来源:bioon”的文字、图片及音视频资料,版权归100医学网网站所有。未经授权,任何媒体、网站、个人不得转载,否则将追究法律责任。获得书面授权转载时,必须注明“来源:100医学网”。其他来源的文章均为转载文章。本网站所有转载文章都是为了传递更多信息。转载内容不代表本站立场。不想被转载的媒体或个人可以联系我们,我们会立即删除。
87%的用户都在使用100医疗网APP随时阅读、评论、分享。请扫描二维码下载-


- 相关报道
-
- Nature:李芝倩等编辑 “隐形基因开关” 使蚊子不再传播疟疾 (2025-08-04)
- 人类也拥有冬眠“超能力”?《科学》背靠背揭开冬眠秘密,或有助于多种疾病治疗 (2025-08-04)
- 8.5亿美元BD交易背后,乐普生物的“成长密码” (2025-08-04)
- GSK 2025H1:肿瘤业务收入大涨,HIV业务保持强势,公司2031年目标锁定400亿+英镑 (2025-08-04)
- Cell:演化的“加速器”,癌症的“催化剂” 揭秘转录因子一体两面的遗传功能 (2025-08-04)
- AI智能体登上Nature子刊!华大智造发布靶向测序引物设计工具PrimeGen (2025-08-04)
- 《柳叶刀》子刊:日行七千步,有八大好处!迄今最大规模/最全面研究发现,日行七千步与八种健康风险最高降低47%相关 (2025-08-04)
- 《循环》:多起/坐,降血压!临床研究结果显示,增加站-坐转换次数、改善久坐行为,可有效降低绝经后女性血压 (2025-08-04)
- Nature:徐墨/高璞合作揭示过敏原诱导免疫应答的共通分子机制 (2025-08-04)
- 四部分发文规范“自媒体”医疗科普信息宣布传达行动 (2025-08-04)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040
 |
 |
| 解决便秘的偏方 | 女孩向往 |
 |
 |
| 婴儿出生时瞬间 | 西红柿养生功效 |
|


















