Nature:徐墨/高璞合作揭示过敏原诱导免疫应答的共通分子机制 |
 |
来源:BioArt 2025-08-02 14:00
本研究解析了经典霉菌过敏原链格孢菌诱导二型免疫反应分子基础,鉴定出其免疫激活活性主要由两个协同作用的打孔蛋白Aeg-S与Aeg-L介导,并揭示了它们通过在呼吸道上皮细胞膜形成跨膜孔道启动过敏反应的机制免疫系统通过不同类型的效应通路识别并应对特定类别的外来侵袭。一型免疫反应(type 1 immunity)主要针对病毒等细胞内病原体,依赖于自然杀伤(NK)细胞、CD8⁺T细胞以及Th1细胞;二型免疫反应(type 2 immunity)则负责清除蠕虫等大型多细胞寄生虫,同时也是引发过敏反应的关键机制,主要由ILC2和Th2细胞介导;而三型免疫反应(type 3 immunity)则针对胞外细菌与真菌,依赖ILC3与Th17细胞等发挥效应功能。
这些免疫通路的激活并非随机,而是由先天免疫识别机制所决定。早在1990年代初,Charles Janeway提出 模式识别 假说(pattern recognition hypothesis),认为宿主通过识别病原体所特有的保守分子结构(PAMPs)来启动免疫反应。这一理论在随后被Jules Hoffmann和Bruce Beutler在90年代中期的开创性研究所验证,他们分别在果蝇与小鼠中发现Toll受体的功能以及TLR4对脂多糖(LPS)的识别,由此奠定了现代先天免疫学的基础。
过去三十年中,随着先天免疫识别通路的持续深入研究,科学家已逐步建立起一套高度体系化的 病原识别图谱 ,使得对病毒、细菌和真菌等引发一型与三型免疫反应的微生物有了深刻而系统的分子机制理解。例如,革兰氏阴性菌的脂多糖(LPS)被细胞膜表面的TLR4识别,同时也可在细胞质中被小鼠Caspase-11或人类Caspase-4/5感知;细菌鞭毛蛋白(flagellin)可通过膜上的TLR5识别,也可被NLR家族受体如NAIP/NLRC4在细胞质内感知。对于病毒,研究已揭示多种 核酸感应路径 :双链RNA被内吞体中的TLR3或胞质内的MDA5识别;5 -三磷酸单链RNA激活RIG-I;而胞质DNA则通过cGAS-STING通路启动下游干扰素信号。此外,TLR7/8可识别病毒RNA,TLR9感知DNA病毒的CpG结构,这些识别事件均在1型干扰素主导的抗病毒免疫中发挥核心作用。
相比之下,二型免疫的先天识别机制至今仍几乎空白,这构成了我们对免疫系统理解的一项重大缺失。一方面,能激活二型免疫的刺激物(如过敏原和寄生虫)在形态、结构和生活史上差异极大,缺乏一致的分子特征;那么,它们是如何被共同识别为二型免疫刺激的?另一方面,在宿主一侧,又是通过哪些细胞类型、分子通路或受体系统感知并应答这些刺激?这些根本问题迄今尚无答案。
本研究正是对这一核心科学问题的系统探索。
2025年7月30日,北京生命科学研究所/清华大学生物医学交叉研究院徐墨课题组、中科院生物物理所高璞课题组、北生所/清华生物医学交叉研究院邵峰课题组合作在Nature杂志上发表了文章Epithelial cell membrane perforation induces allergic airway inflammation。该研究发现,在呼吸道上皮细胞膜上形成跨膜孔洞的活性,作为一种普适的二型免疫刺激,存在于多种过敏原中,此活性通过诱导钙离子内流和IL-33释放,激活下游过敏反应。这项研究揭示了过敏原诱导免疫应答的共通分子机制,填补了长期悬而未解的二型先天免疫识别知识缺口,拓展了对过敏发生机制的基础认识。

为了研究二型免疫的先天识别机制,徐墨实验室设计了一个以细胞培养为基础的研究体系,旨在重建过敏原或寄生虫在体内诱导先天免疫反应的早期过程。研究团队设想,如果能在培养皿中还原这一免疫启动过程,便可借助该体系开展两类关键实验:其一,以体外培养的细胞对二型免疫刺激的早期应答为指标,对成分复杂的过敏原、寄生虫的提取物进行活性追踪纯化,鉴定出其中诱发免疫反应的核心活性成分;其二,利用CRISPR介导的高通量遗传筛选,系统寻找宿主细胞中潜在的识别受体与下游信号转导通路。
为此,他们系统测试了数十种二型免疫刺激物,涵盖过敏原、寄生虫等各种来源,将其分别作用于十余种呼吸道上皮细胞、肠道上皮细胞、皮肤成角质细胞等屏障细胞系,筛选是否可在体外激活二型免疫应答的早期标志。经过大规模排列组合测试后,他们发现,一种经典的霉菌过敏原 链格孢菌(Alternaria alternata) 可在体外培养的肺上皮细胞系中和小鼠呼吸道内诱导三种相同的反应:IL-33释放、MAPK信号通路激活、以及多种二型免疫相关炎症因子的表达(其中炎症因子的表达依赖于MAPK通路激活),证明体外体系对体内过程的有效重建。
链格孢菌是一种植物寄生真菌,广泛分布于全球各地,夏秋季节其孢子随空气传播,成为常见的呼吸道敏原。据流行病学研究,在某些地区,该霉菌可能与超过20%的季节性呼吸道过敏病例有关。
接下来,研究团队以链格孢菌提取物为起点,开展活性追踪纯化,通过六步层析分离,成功鉴定出核心免疫刺激活性组分。在纯化过程中,诱导IL-33释放、激活MAPK通路以及促炎基因表达这三种活性始终随同洗脱(co-elute),证明它们源自同一类功能性分子。经质谱鉴定,该免疫刺激活性由两个蛋白共同承担。其中一个分子量约16.5 kDa,属于aegerolysin家族。这类蛋白广泛存在于真菌中,具有结合细胞膜上鞘磷脂和胆固醇的能力,据此将其命名为Aeg-S(aegerolysin small)。另一个蛋白为分子量约55 kDa,被命名为Aeg-L(aegerolysinlarge),它包含MACPF结构域(membrane attack complex/perforin)。MACPF结构域是一种保守的成孔结构模块,广泛存在于免疫系统与微生物中的膜攻击因子,可插入靶细胞膜形成孔道,引发细胞裂解。在多种真菌中,MACPF结构域蛋白常与aegerolysin家族蛋白协同作用,组装为二元多聚体穿孔毒素(binary pore-forming toxins),通过膜穿孔导致靶细胞破裂。值得一提的是,这类二元成孔系统不仅存在于链格孢菌,也广泛分布于三大主要真菌过敏原属:链格孢菌属(Alternaria)、曲霉菌属(Aspergillus)以及青霉菌属(Penicillium),提示其在真菌过敏反应中可能具有保守的致敏功能。
经过反复尝试,研究者们成功制备了具有活性的Aeg-S和Aeg-L重组蛋白,用于开展机制研究。中科院生物物理研究所高璞实验室结合体外重组和冷冻电镜(cryo-EM)技术,解析了Aeg-S与Aeg-L协同形成的跨膜孔道结构及其作用机制。Aeg-S和Aeg-L可特异结合富含鞘磷脂和胆固醇的脂质体,并协同组装形成16至20个重复单元的跨膜孔道复合物。该复合物呈大型环状结构,在18聚体情况下,其外径约232 ,内径约为92 。每个重复单元由一分子Aeg-L和两分子Aeg-S组成,沿孔道轴心呈对称排列。这一高分辨率结构揭示了Aeg-S与Aeg-L通过特定的分子配比与空间协作,在靶细胞膜表面完成组装并实现膜穿孔的分子机制,为理解其如何诱导宿主细胞的免疫激活过程提供了结构基础。
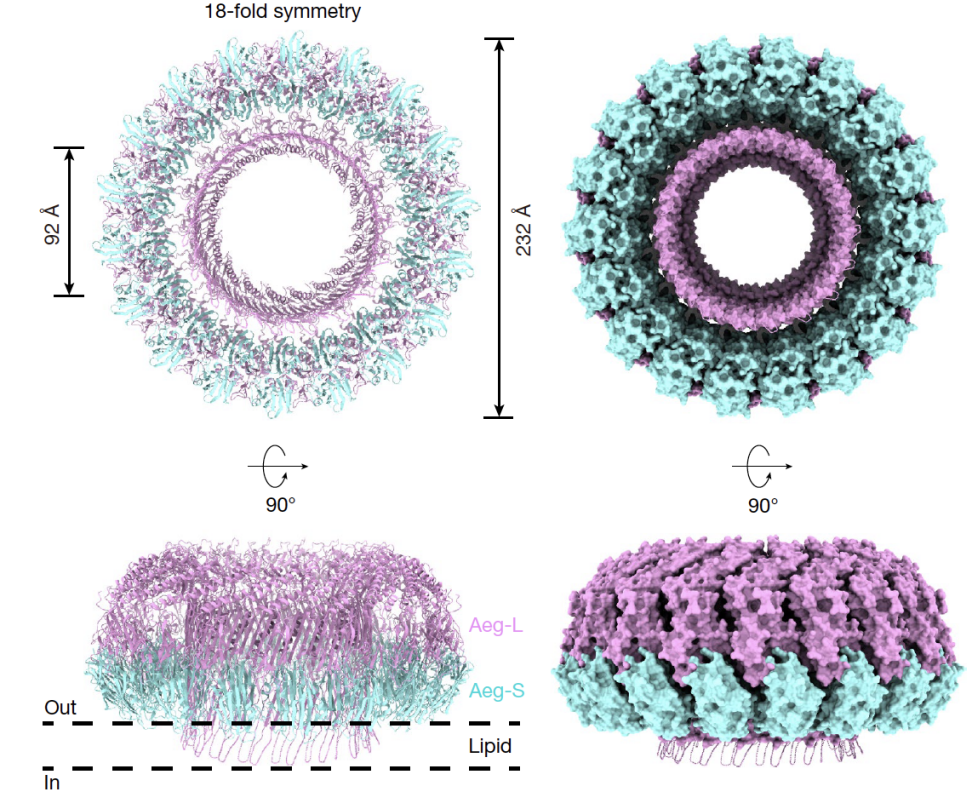
Aeg-S 与 Aeg-L(Aeg-S/L)孔道复合物的冷冻电镜结构解析
接下来,研究者们借助体外细胞培养体系解析了Aeg-S与Aeg-L的免疫激活机制。它们介导的膜穿孔可通过两条途径启动二型免疫反应:一方面诱导IL-33的释放,另一方面引发细胞外Ca ⁺内流,继而激活MAPK信号通路,并驱动一系列下游炎症基因的表达。Ca ⁺内流是MAPK通路激活的必要前提,应用Ca ⁺螯合剂可阻断MEK和ERK的磷酸化,而使用MEK1/2抑制剂trametinib则可抑制炎症基因的上调。与此同时,ATP等与二型免疫相关的alarmin也在刺激后被释放。
更为关键的是,使用Aeg-S与Aeg-L重组蛋白就足以在小鼠体内强烈诱导呼吸道过敏。将两种蛋白联合滴鼻刺激小鼠,6小时后,可在肺中观察到与链格孢菌提取物刺激相同的早期应答,包括上皮细胞释放IL-33、MAPK信号通路的激活,以及下游炎症因子的表达。若持续以Aeg-S和Aeg-L联合刺激小鼠两周,可在呼吸系统诱导典型的过敏性炎症,表现为嗜酸性粒细胞大量浸润、Th2细胞积累及血清IgE水平升高。相比之下,单独使用Aeg-S或Aeg-L均无法诱导上述任何反应,表明二者协同作用在细胞膜穿孔是导致过敏的基础。与经典一型/三型免疫佐剂脂多糖(LPS)对比表明,Aeg-S和Aeg-L具备专一的二型免疫佐剂特性。LPS可促进呼吸道中抗原特异Th1和Th17应答,但不诱导Th2或IgE生成;而Aeg-S与Aeg-L则专一辅助诱导抗原特异Th2及IgE反应,却不支持Th1或Th17应答。

为评估Aeg-S与Aeg-L在链格孢菌诱导过敏反应中的具体贡献,研究者们借助真菌遗传学手段,构建了分别缺失aegs或aegl基因的链格孢菌突变株。用这些突变菌株的提取物反复滴鼻刺激小鼠两周后发现,原本能够强烈诱导二型免疫炎症的野生型链格孢菌,在缺失Aeg-S或Aeg-L二者之一后,完全丧失了引发呼吸道Th2细胞积聚、嗜酸性粒细胞浸润及血清IgE升高的能力。值得注意的是,当在突变菌提取物中回补了相应的重组Aeg-S或Aeg-L蛋白后,其诱导过敏反应的能力得以重建。这些结果表明,Aeg-S与Aeg-L协同介导的细胞膜打孔构成了该真菌的核心致敏机制。
在明确Aeg-S与Aeg-L通过成孔激活二型免疫反应后,研究者进一步提出假设:各种结构各异的打孔毒素(pore-forming toxins,PFTs)是否普遍具有在诱导二型免疫应答的能力?想要获得来自诸多不同物种的具有活性的打孔蛋白难度极大,对实验室的生物化学功底和对膜穿孔蛋白的理解有很高要求。在邵峰实验室曾欢博士的努力下,研究团队筛选并获得了六种额外的PFTs,包括来自经典过敏原黑曲霉的NigA2和NigB1、具有过敏反应潜能的海葵毒素Eqt II,以及来源于非典型过敏原的蚯蚓lysenin、杏鲍菇PlyA2和EryB、产气荚膜梭菌PFO和硫黄菌LSL。它们靶向细胞膜上的不同分子组分,形成的穿孔直径从约3纳米至45纳米不等。将这些PFTs以滴鼻方式反复刺激小鼠两周后发现,尽管它们在来源、结构和机制上各不相同,均可强有力的在呼吸道诱导过敏性炎症。这表明,呼吸道上皮细胞膜的穿孔可被免疫系统识别为来自二型免疫刺激物的共通的 危险特征 ,由此启动相似的免疫应答。这为理解多种含PFTs刺激物(包括霉菌及动物毒素)共同诱导过敏提供了机制基础。
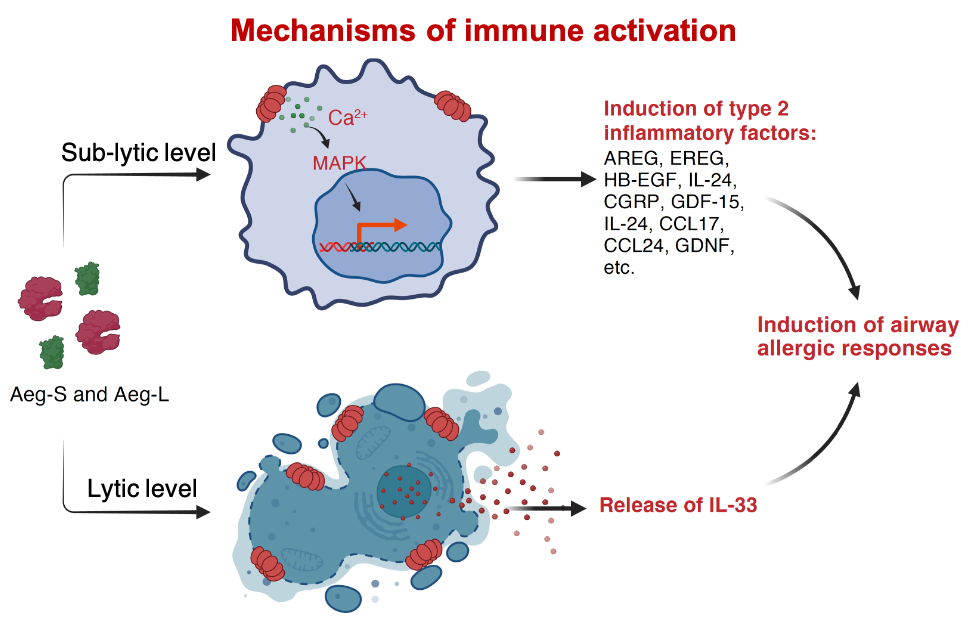
综上所述,本研究解析了经典霉菌过敏原链格孢菌诱导二型免疫反应分子基础,鉴定出其免疫激活活性主要由两个协同作用的打孔蛋白Aeg-S与Aeg-L介导,并揭示了它们通过在呼吸道上皮细胞膜形成跨膜孔道启动过敏反应的机制。更具普适意义的是,研究进一步发现,来自不同物种、结构各异的多种打孔毒素均可通过类似机制诱导呼吸道过敏反应,提示 细胞膜穿孔 可作为一种共同的免疫识别信号,引发二型免疫应答。这为长期缺乏了解的二型免疫先天识别机制提供了新的认知。这些发现表明,与一型和三型免疫依赖于识别保守病原分子模式(如LPS、核酸等)不同,二型免疫似乎更倾向于感知结构多样的刺激物所引发的共同组织扰动(tissueperturbation)。尽管既有研究表明某些打孔蛋白也可激活一型或三型免疫反应,本研究首次明确指出在呼吸道环境中,膜穿孔可特异性诱导二型免疫。这也引发了有趣科学问题:为何相同的膜损伤信号在不同组织或免疫微环境中会引发截然不同的免疫结局?可能的决定因素包括协同炎症信号的组合或组织微环境的差异等。Aeg-S与Aeg-L构建的体内外实验模型为进一步解析 穿孔 感知 免疫激活 路径以及研究二型先天免疫反应的早期过程提供了新工具。
北京生命科学研究所/清华大学生物医学交叉研究院徐墨研究员、中科院生物物理研究所高璞研究员为本论文的共同通讯作者,邵峰研究员为研究提供了关键支持。徐墨实验室的毕业生史可见博士、博士研究生吕垚,高璞实验室的赵春秋博士为论文的共同第一作者。邵峰实验室的曾欢博士、徐墨实验室技术员王叶琼为研究作出了重要贡献。本论文的其他作者包括刘宇璇、李琳和陈涉博士。
原文链接:
https://doi.org/10.1038/s41586-025-09331-1
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Nature子刊:浙江大学方向前/赵玥绮/唐睿康/刘昭明团队开发抗衰老的时空自适应纳米疗法 (2025-10-07)
- Neuron:大脑“超清摄像头”问世!神经观测有望进入新时代 (2025-10-07)
- 科研人员绘制图谱解析风险SNP驱动的促肿瘤机制 (2025-10-06)
- Nature子刊:邓攀团队提出AI框架——CellNavi,为细胞研究装上“导航仪” (2025-10-06)
- Nature头条:如何才能科学地睡个好觉?做到这三点至关重要 (2025-10-05)
- 中国科学院最新论文,登上Science封面 (2025-10-05)
- 《细胞》子刊:微生物守护卵巢健康!科学家发现,雌性小鼠生育年龄与微生物有关,微生物代谢物可防止卵巢储备加速流失 (2025-10-04)
- 珍·古道尔的遗产:她改变科学的三种方式 (2025-10-04)
- Nature Aging:沈舒滢/季明亮/赵兴团队发现骨关节炎治疗新靶点,并提出基于LNP-mRNA的新疗法 (2025-10-03)
- Nature Medicine:颠覆认知!体重不减反增,为何依然能逆转糖尿病前期? (2025-10-03)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















