纳米生物技术:利用改进的CRISPR |
 |
来源:100医疗网原创2022-08-30 10336031
CRISPR-Cas9基因编辑系统的新变体使得对大量细胞进行遗传修饰以用于治疗应用变得更加容易。
CRISPR-Cas9基因编辑系统的新变体使得对大量细胞进行遗传修饰以用于治疗应用变得更加容易。这种方法由Gladstone Institute和加州大学旧金山分校开发,使科学家能够以非常高的效率将超长DNA序列引入细胞基因组的精确位置,而不需要传统上用于将DNA携带到细胞中的病毒传递系统。相关研究成果于2022年8月25日在线发表在《自然生物技术》杂志上,题目是“使用杂交SS DNA修复模板和小分子鸡尾酒在原代细胞中进行高产基因组工程”。

该论文的合著者亚历山大马森博士表示,多年来,我们的目标之一是以不依赖于病毒载体的方式将冗长的DNA指令引入基因组中的靶位点。这是迈向下一代安全有效的细胞疗法的一大步。
在这篇论文中,Marson和他的同事们不仅描述了这项技术,还展示了如何利用它来构建具有对抗多发性骨髓瘤(一种血液癌症)潜力的细胞,并重写突变后可能导致罕见遗传疾病的基因序列。
该论文的合著者、马森实验室的临床研究员布莱恩什伊(Brian Shy)博士说,我们发现,我们可以在一次手术中对超过10亿个细胞进行基因改造,这远远超过了我们治疗一名患者所需的细胞数量。
从双链DNA到单链DNA
CRISPR-Cas9是一个在活细胞中进行基因编辑的系统,在过去十年中一直被用作基础研究工具。越来越多的临床科学家对使用CRISPR-Cas9开发活细胞疗法的潜力感到兴奋。通过基因编辑,人们可以关闭、消除或替换突变的和致病的基因,或者提高免疫细胞的抗癌活性,等等。虽然CRISPR-Cas9的第一个治疗应用最近进入了临床试验,但这项技术仍然受到安全制造大量正确编辑的细胞的挑战的限制。
传统上,科学家依靠病毒载体——没有致病成分的病毒外壳携带DNA(称为DNA模板)进行基因治疗进入细胞。然而,大量临床病毒载体的生产一直是将细胞疗法带给患者的主要瓶颈。此外,人们无法轻松控制传统病毒载体在基因组中插入基因的位置。
Shy说,使用病毒载体是昂贵的,并且需要大量的资源。非病毒基因工程方法的一个主要好处是,我们不会像以前那样受到成本、制造复杂性和供应链挑战的限制。
2015年,Marson团队与CRISPR的先驱Jennifer Doudna博士的实验室合作,首次展示了他们可以在不使用病毒载体的情况下,在利用电场使细胞外膜更加透明的情况下,将短dna模板插入免疫细胞。2018年,他们开发了一种用CRISPR将长DNA序列递送到免疫细胞中的方法(Nature,2018,doi :10.1038/s 41586-018-0326-5)。
然后,在2019年,马森的团队发现,通过同时使用一种可以与Cas9酶结合的改进的DNA模板,cas 9酶是一种在CRISPR基因编辑过程中充当分子剪刀的蛋白质,他们可以更有效地将新序列传递到基因组中的目标位点(Nature Biotechnology,2019,doi:10.1038/S41587-019-019)
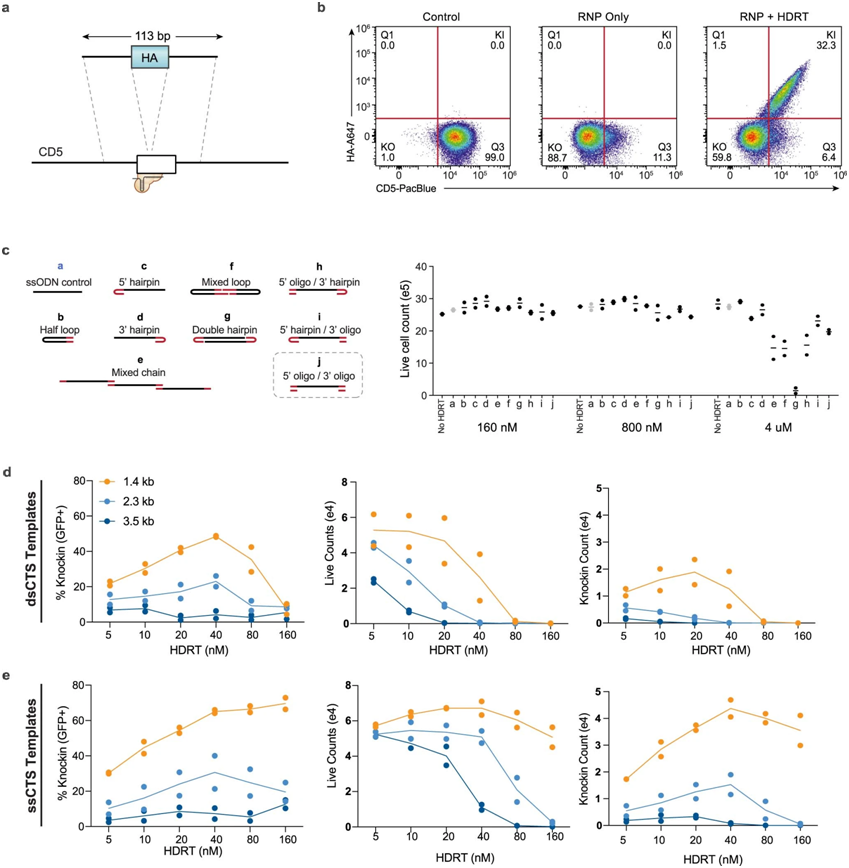
CTS(Cas9靶序列)模板设计对比,图片来自Nature Biotechnology,2022,doi :10.1038/s 41587-022-01418-8。
然而,需要更多的研究工作来提高已经成功进行遗传修饰的免疫细胞的产量,并使这一过程与未来细胞疗法的制造相兼容。这些目标促使马森的团队开展这项新的研究。
DNA可以以单链或双链的形式存在,Cas9会附着在双链DNA上。这些作者很快发现高水平的双链DNA模板对细胞有毒性,所以这种方法只能用于低水平的模板DNA,会导致编辑效率低下。
马森团队知道,即使在相对较高的浓度下,单链DNA对细胞的毒性也较小。因此,在这篇新论文中,他们描述了一种将改进的Cas9酶附着到单链DNA模板上的方法,只需在两端添加一个短的悬空双链DNA。马森说,这给了我们一个平衡的两全其美的方法。
与传统的双链DNA模板相比,单链DNA模板可以将基因编辑的效率提高一倍以上。单链DNA分子的双链末端允许人们使用Cas9来增强非病毒载体在细胞中的传递。
该论文的合著者、旧金山加州大学实验室医学助理教授乔纳森艾森斯坦博士说
项技术有可能使新的细胞疗法和基因疗法更快、更好、更便宜。通往临床的道路
在这项新的研究中,这些作者使用新的DNA模板产生了超过10亿个靶向多发性骨髓瘤的CAR-T细胞。CAR-T细胞是经过基因改造的T细胞,可以有效对抗特定的细胞或癌症。有了新的由Cas9指导的单链模板,大约一半的T细胞获得了新的基因,因而被转化为CAR-T细胞。
论文共同作者、加州大学旧金山分校血液学与肿瘤学科医学助理教授Justin Eyquem博士说, 我们知道,将DNA模板靶向基因组中称为TRAC(T-cell receptor constant, T细胞受体 恒定区)位点的特定位点,将会提高CAR-T细胞的抗肿瘤效力。这种新的非病毒方法使我们能够更有效地实现这一目标,这将加快下一代CAR-T细胞疗法的开发。
此外,这些作者发现他们的方法首次可以完全替换与罕见遗传性免疫疾病相关的两个基因,即IL2RA和CTLA4基因。
在过去,科学家们已发现他们可以替换IL2RA基因中特定患者发生突变的较小部分。如今,Marson团队证实他们可以一次性替换整个IL2RA和CTLA4基因---一种 一体适用 的方法,可以治疗这些基因发生不同突变的许多患者,而不必为每名患者的突变构建个性化的DNA模板。用这种基因工程方法处理的T细胞中,近90%获得了健康版本的基因。
Marson团队如今正在寻求批准,以推进在CAR-T细胞治疗和IL2RA缺乏症治疗中使用非病毒CRISPR技术的临床试验。( 100yiyao.com)
参考资料:
1. Brian Shy et al. . Nature Biotechnology, 2022, doi:10.1038/s41587-022-01418-8.
2. A Cellular Engineering Breakthrough: High-Yield CRISPR Without Viral Vectors
https://gladstone.org/news/cellular-engineering-breakthrough-high-yield-crispr-without-viral-vectors
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Bio-Protocol:北京妇产医院刘朝晖团队成功构建“内膜外翻”的人子宫内膜类器官(含详细操作步骤) (2025-09-18)
- 18款1类新药首次在中国获批临床! (2025-09-18)
- Cell:mRNA疫苗,进军肺结核领域,增加并超越卡介苗保护效果 (2025-09-18)
- Nature子刊:AI从头设计多肽,精准抑制细胞焦亡,开辟炎症疾病治疗新途径 (2025-09-18)
- Nature:胃的“南北战争”!神经组织竟是调控胃功能分区的幕后指挥官 (2025-09-18)
- Nature Medicine:胖,但健康!遗传学如何“解绑”肥胖与心脏病的宿命关联? (2025-09-17)
- 国内唯一获批干细胞药物首位患者出院,国产干细胞药品取得临床应用突破 (2025-09-16)
- 《自然》:慢性压力毁血糖!科学家发现全新调控血糖神经通路,可快速调节肝脏糖生成,反复压力会钝化此通路,导致糖代谢受损 (2025-09-16)
- FDA监管趋严,如何影响中国创新药出海? (2025-09-16)
- JAMA子刊:重大突破!北京安定医院团队首次证实,ANK3可以预测liafensine治疗难治性抑郁症的疗效 (2025-09-16)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















