科学:饥饿的癌细胞如何通过分解蛋白质来转化其“食物”来源以供能量? |
 |
来源:生物世界2022-09-17 08336020
研究表明,一种叫做LYSET的蛋白质是允许癌细胞进行这种代谢转变的关键。这项研究也为癌症治疗提供了新的靶点。
众所周知,营养素是不可或缺的资源,为哺乳动物细胞的生长和生存提供能量。当营养充足时,细胞会通过质膜转运氨基酸,首先满足自己对外来氨基酸的需求。而循环的细胞外物质大部分是蛋白质,在细胞内可以通过大胞作用和溶酶体分解代谢分解成氨基酸。有了这些细胞外丰富的蛋白质储备,细胞可以在饥饿时维持生命。
与正常细胞相比,癌细胞通常在营养缺乏的环境中生长。因此,他们必须改变他们的新陈代谢,以支持他们更多的能量需求。最显著的变化是肿瘤糖酵解增加,导致葡萄糖摄取和利用增加。这也是一个世纪以来华宝效应的核心理念。
但越来越多的研究发现,氨基酸、乳酸、醋酸、大分子等非葡萄糖营养物质也被癌细胞作为替代能源。在这些恶性细胞中,与大红细胞症和溶酶体分解代谢相关的信号通路被上调。由此导致的细胞外蛋白质摄取和溶酶体分解的增加构成了氨基酸的另一个来源,这使得癌细胞能够在营养缺乏的肿瘤环境中生长。这意味着癌细胞和正常细胞一样,确保它们在饥饿期间不缺乏食物。然而,这种转化的机制在很大程度上仍然是未知的。
2022年9月8日,由德国癌症研究中心的威廉帕尔姆(Wilhelm Palm)和奥地利维也纳分子病理学研究所的约翰内斯祖贝尔(Johannes Zuber)领导的国际研究团队在国际顶级学术期刊《科学》(Science)上发表了题为《溶酶体酶运输因子lyset enablers胞外蛋白的营养利用》的研究论文。
癌细胞通常生长在低营养含量的环境中,它们可以通过改变代谢以利用蛋白质作为食物来源来应对这一挑战。最新研究表明,一种名为LYSET的蛋白质是让癌细胞进行这种代谢转变的关键。这项研究也为癌症治疗提供了新的靶点。

对于以蛋白质为食的人类癌细胞(绿色标签)(蓝色是癌细胞的细胞核),蛋白质在溶酶体中分解成氨基酸(洋红色)。
它是氨基酸蛋白质的组成部分,也是细胞生长和增殖的关键营养素。了解细胞如何在不同环境中利用氨基酸是基础生物学和癌症研究的核心问题。
Helmpalm实验室是最早描述癌细胞以细胞外蛋白为食的能力的实验室之一。在这项新的研究中,为了更好地了解癌症中营养转化的分子途径,研究小组建立了筛选条件,在这些条件下,细胞生长可以吸收单体氨基酸,或者由胞外蛋白的巨细胞胞饮和溶酶体分解代谢支持。为了选择性地加强任何种类的营养获取,必需氨基酸亮氨酸以其单体形式提供或包含在白蛋白中。
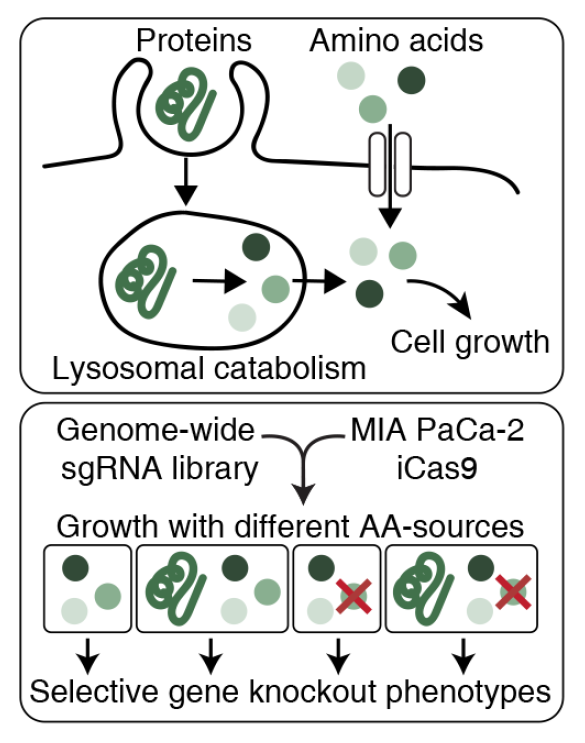
然后,他们选择了一种营养缺乏的肿瘤类型,细胞外蛋白是氨基酸的重要来源。实验表明,当白蛋白添加到生理水平(3-4%)时,肿瘤模型中的细胞可以通过溶酶体白蛋白分解代谢在缺乏亮氨酸的培养基中维持增殖。
接下来,他们使用CRISPR-Cas9筛选技术确定了与营养转化相关的几个途径。
研究小组发现,当细胞以白蛋白为食时,一个重要的选择性关键基因是跨膜蛋白TMEM251,研究小组将其命名为LYSET(溶酶体酶转运蛋白)。
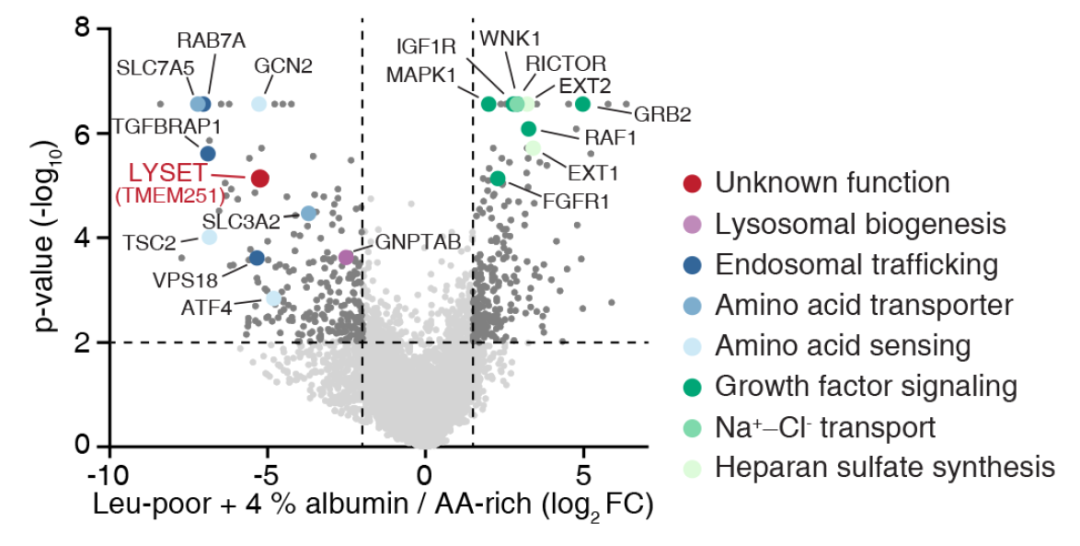
LYSET是一种131个氨基酸残基的小跨膜蛋白,与其他蛋白质缺乏明显的同源性。
LYSET是在营养丰富的条件下细胞活力和生长的非必需基因。然而,在缺乏亮氨酸并补充有3%白蛋白的培养基中,LYSET的缺失强烈抑制了所有癌细胞系、小鼠胚胎成纤维细胞和肾细胞的增殖和活力。这表明当细胞外蛋白是必需营养物时,在体外氨基酸耗尽的条件下和在体内肿瘤生长期间,LYSET是必需基因。
对LYSET功能的进一步实验表明,该基因是甘露糖-6-磷酸(M6P)途径的核心成分,是溶酶体酶转运所必需的,因此也是溶酶体营养物质生产所必需的。溶酶体是一种小的细胞器。作为细胞的胃,蛋白质被困在溶酶体中。然而,在没有LYSET的情况下,癌细胞的溶酶体缺乏酶,因此它们不再能够消化蛋白质。
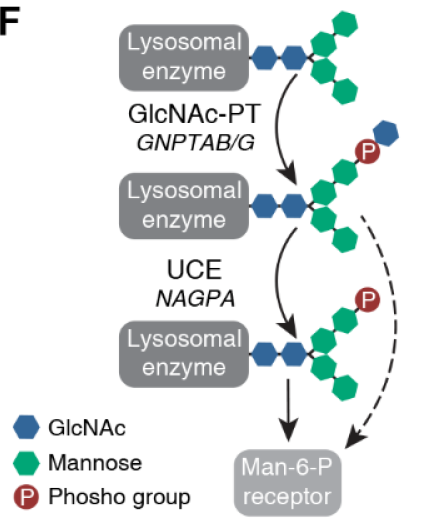
最后,
研究人员使用小鼠模型研究了 LYSET 在真实肿瘤中的功能。他们发现,LYSET 缺失在几种类型的癌症中强烈抑制了肿瘤的发展;但在正常的营养条件下,LYSET 的耐受性良好。Wilhelm Palm表示,通过鉴定出 LYSET,发现了一个能适应不同营养代谢途径的核心成分。该途径对溶酶体生理学、细胞外蛋白质的营养利用和癌症的代谢适应至关重要。这是癌细胞在恶劣的肿瘤环境中生存和生长的关键能力。
Johannes Zuber表示,这项研究结果揭示了 LYSET 和 M6P 途径对依赖溶酶体分解代谢产生营养素的细胞基本功能,并证明该途径对癌细胞特别重要。因此,这一途径有望成为攻击癌症主要代谢瓶颈的分子切入点。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Nature Biotechnology:FUGAsseM利器出鞘——一种基于微生物群落共表达的功能预测新范式 (2025-10-18)
- Cell:西湖大学卢培龙团队等首次从头设计出电压门控离子通道,在体内抑制神经元电活动 (2025-10-18)
- Cell子刊:毕楠/崔明/葛红等人揭示肠道菌群可预测肺癌巩固免疫治疗效果及放化疗毒性 (2025-10-17)
- Neuron:高郑润/徐天乐/吴逸雯等揭示中风后情绪障碍的新机制 (2025-10-17)
- Nature系列综述:西湖大学董晨院士系统总结CD8⁺T耗竭的调控因子 (2025-10-16)
- 由趋势观前沿:毕马威正式发布第三届生物科创领航50企业报告 (2025-10-15)
- 从“假基因”到“致病元凶”!Brain新研究:SSPOP基因复合杂合突变诱发儿童癫痫,多模型证实其功能与致病机制 (2025-10-15)
- Science:“吃不胖”的免疫学新解——T细胞胆固醇稳态是决定膳食脂肪吸收的关键 (2025-10-15)
- 迈威生物靶向 CDH17 ADC 创新药 7MW4911 临床试验申请获得 NMPA 批准 (2025-10-14)
- 西湖大学开发AI科学家,实现全自动科学发现,两周搞定人类科学家三年工作 (2025-10-14)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















