Osekan火力全开!获得4个重首仿和20个超评品种 |
 |
在疫情的冲击下,Osekan加速创新转型。R & ampd 2022 h1投资较去年同期增长21.35%,占营收的24.81%。2019年以来,公司9个品种(含4个首仿品种)首次获准上市,20个品种进行了评价(7个为首仿/独家);以高壁垒的创新药和复方制剂为重点,乐施会有45个研究项目,13个新药(7个一类新药)在国内处于批准临床及以上阶段。第一个1类新药可以上市。仿制药方面,16个新分类申报品种正在审评中,9个未获得首次批准(包括剂型首仿),其中7个为乐施会独家/首次申报。
4个重磅首仿获批,20个品种过评
乐施会是中国领先的PPI注射剂企业之一,上市的6家PPI注射剂中有5家。近年来,乐施会从消化科单一的PPI产品线逐年扩展到抗感染、抗肿瘤、糖尿病等治疗领域,剂型也从单一的注射剂扩展到口服制剂。
Minenet数据显示,2019年以来,乐施会共有9个仿制药首次获批,其中4个为首次仿制(含剂型首次仿制),包括地拉罗斯分散片、泊沙康唑注射液、泊沙康唑肠溶片(独家代理)、沙格列汀片。另外,注射用替莫唑胺第二次获批,注射用达托霉素(350mg)为独家规格。
2019年起,乐施会被批准为品种。
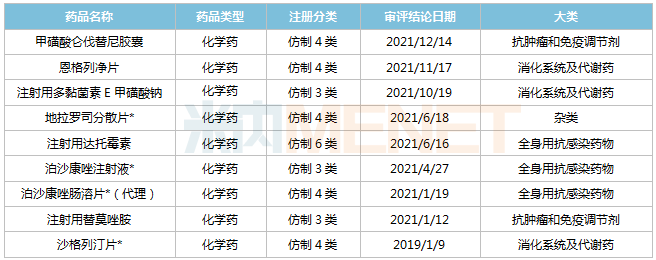
注:*为首次仿制(包括剂型的首次仿制)
来源:Minenet MED2.0中国药物评价数据库
狄洛洛斯分散片、泊沙康唑注射液、泊沙康唑肠溶片是我国第一批鼓励类仿制药,其中狄洛洛斯是目前唯一有效治疗铁超载的药物,泊沙康唑是新一代三唑类抗真菌药物;沙格列汀片是DPP4抑制剂,是乐施会批准上市的首个口服降糖药。
目前,乐施会已有20个品种通过或被视为通过一致性评价,集中在两大治疗领域:消化系统及代谢药物(8个品种)和抗肿瘤及免疫调节剂(7个品种);7个品种为首次/独家评价,其中注射用右美沙芬、沙格列汀片、泊沙康唑注射液、地克罗分散片为首次评价。
Osekan已被鉴定品种。
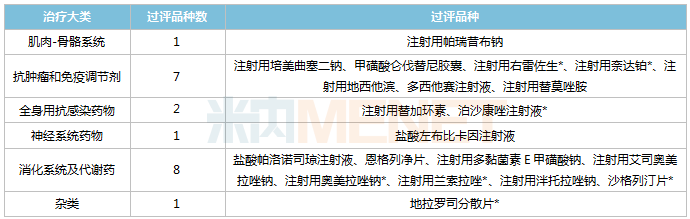
注:*为第一篇/独家综述。
来源:Minenet MED2.0中国药物评价数据库
Osekan积极响应国家组织的药品集采,以实际行动切实减轻患者的药品负担。目前公司共有12个品种,其中第四批2个,第五批6个,第七批4个。
公司已评估的品种中,有6个未纳入国家集中采购,其中盐酸左布比卡因注射液已评估的企业达到4家,达到集中采购门槛。根据Minenet的数据,盐酸左布比卡因注射液在中国城市公立医院、县级公立医院、城市社区中心、乡镇卫生院(国内简称公立医疗机构)的销售规模较小,乐施会的市场份额也较小。
13款新药在路上,首款1类新药上市在即
围绕消化系统、抗肿瘤、抗感染、慢性病四大领域,欧司康不断加大研发力度;d的努力,及其研发;d投入逐年增加,其研发经费也逐年增加。d强度(R & ampd投资占收入的比重)逐渐增加。2022年上半年,公司投入2.51亿元用于研发;d,同比增长21.35%,占营收的24.81%。
2018-2022H1研发;d .乐施会的投资(单位:亿元)
//www.pharmnet.com.cn//image/upload/images/20220930083821.png" style="height:285px; width:550px" />来源:公司公告
奥赛康目前主要在研项目共计45项,聚焦小分子靶向创新药、肿瘤免疫领域生物创新药的研发,已经实现了定位于临床亟需、着眼于创新药、高端首仿药的研发战略转型。
米内网数据显示,目前奥赛康在国内有13款新药(7款1类新药)处于获批临床及以上阶段,包括ASK120067片、ASKB589注射液、ASKG712注射液等1类新药,注射用右兰索拉唑、右旋硫辛酸氨丁三醇注射液、注射用格列本脲等改良型新药。
奥赛康国内在研新药
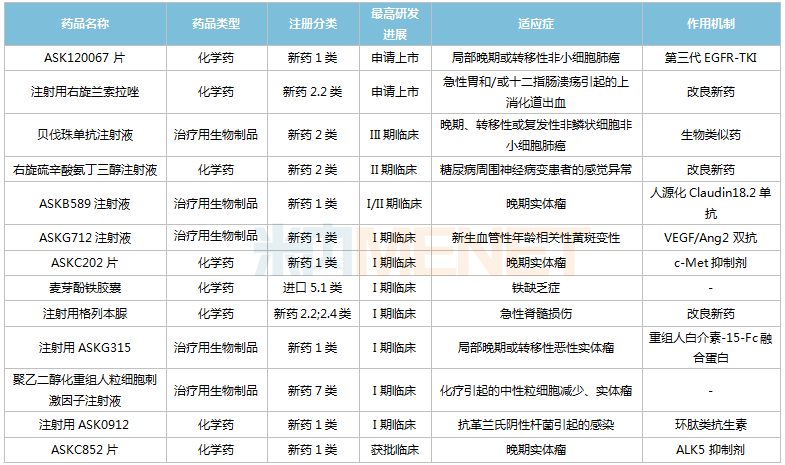
来源:米内网中国药品临床试验公示库
化学创新药方面,ASK120067片于2021年11月提交上市申请,并已完成临床现场核查和注册现场核查,有望成为公司首款获批上市的1类新药。这是一款三代EGFR-TKI,国内已获批同靶点药物包括奥希替尼、阿美替尼、伏美替尼等。近年来,以替尼类药物为主的蛋白激酶抑制剂在中国三大终端6大市场(统计范围详见本文末)的销售规模逐年上涨,2021年达388.6亿元,同比增长18.2%。
此外,处于I期临床的注射用ASK0912为环肽类抗生素,奥赛康于2019年与中国医学科学院达成技术开发协议;已获批临床的ASKC852片属于ALK5抑制剂,目前国内外暂无同靶点药物获批,国内在研品种包括劲方药业的GFH018片(II期临床)、上海璎黎药业的YL-13027片(I期临床)等。
生物创新药方面,正在开展I、II期临床的ASKB589注射液为人源化Claudin18.2单抗,通过ADCC和CDC杀伤肿瘤细胞。目前国内外暂无同靶点药物获批上市,奥赛康处于研发第一梯队;步入I期临床的注射用ASKG315属于重组人白介素-15-Fc融合蛋白,目前国内外暂无同靶点药物获批上市,国内在研新药最高进展处于II期临床;正在开展I期临床的ASKG712注射液为VEGF/Ang2双抗,公司与Affamed达成合作,目前该新药已在美国完成I期临床首例患者给药。
9个品种抢首仿,2款注射剂冲击首家过评
在仿制药方面,目前奥赛康有2个品种提交一致性评价补充申请在审,分别为注射用雷贝拉唑钠及注射用奥沙利铂,2个品种在2021年中国公立医疗机构终端的销售额分别超过15亿元、30亿元,目前均无企业过评或视同过评。
新分类申报方面,目前奥赛康有16个品种以新分类申报在审,其中9个暂无首仿(含剂型首仿)获批,苹果酸卡博替尼片、注射用德拉沙星、注射用福奈妥匹坦帕洛诺司琼等品种在国内市场空白。
奥赛康新分类申报且暂无首仿获批的品种
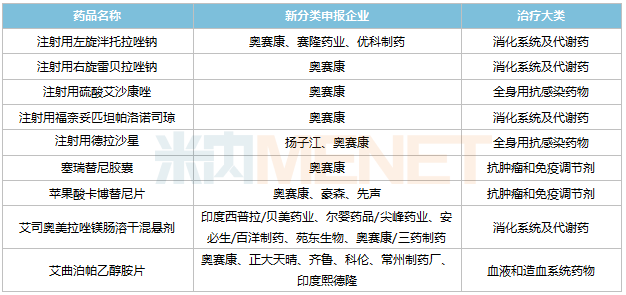
来源:米内网MED2.0中国药品审评数据库
7个品种由奥赛康独家/首家申报,其中右雷贝拉唑钠、左泮托拉唑钠分别是雷贝拉唑钠、泮托拉唑钠的优势构型,若获批上市,将有助于巩固奥赛康在PPI领域的地位。
近年来中国三大终端6大市场艾曲泊帕乙醇胺片销售情况(单位:万元)
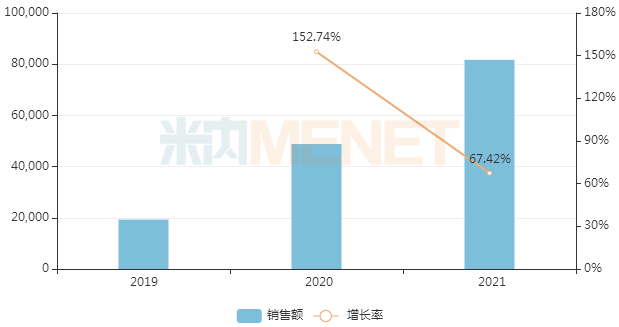
来源:米内网数据库
首仿之争最激烈的艾曲泊帕乙醇胺片是FDA批准的首个血小板减少症(ITP)口服药物,2021年全球销售额超过20亿美元,而在中国三大终端6大市场的销售额则超过8亿元,同比增长67.4%。
资料来源:米内网数据库、公司公告等注:米内网《中国三大终端6大市场竞争格局》,统计范围是:城市公立医院和县级公立医院、城市社区中心和乡镇卫生院、城市实体药店和网上药店,不含民营医院、私人诊所、村卫生室,不含县乡村药店;上述销售额以产品在终端的平均零售价计算。数据统计截至9月26日,如有疏漏,欢迎指正!
医药网新闻
- 相关报道
-
- 上海生物医药家当规模预计本年破万亿元 (2025-10-10)
- 国度药监局对于扶正摄生丸转换为非处方药的布告 (2025-10-10)
- 国度金融监管总局宣布推进安康保险高质量倒退的指导意见 (2025-10-09)
- 慢阻肺病归入根本公卫服务落地追踪:“呼吸之痛”若何缓解? (2025-10-09)
- 若何替行为方便白叟用医保开药?国度医保局解答 (2025-10-09)
- 国度医保目次抗癌药品已超230种 (2025-10-09)
- 收益率达8.1% 2024年全国社保基金取得较好投资业绩 (2025-09-30)
- 山东三部分推进药品运营使用环节全种类信息化追溯系统建设 (2025-09-28)
- 国度药监局对于牙膏立案治理无关事项的布告(征求意见稿) (2025-09-28)
- 新疆医疗程度正迈向智能化、精准化新阶段 (2025-09-26)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















