JCI:清华大学团队发现如何在非小细胞肺癌中破解EGFR |
 |
来源:奇点蛋糕2022-11-03 11336013
EGFR-TKIs已成为非小细胞肺癌(ns CLC)EGFR敏感突变患者的标准治疗方法[1]。
EGFR-TKIs已经成为非小细胞EGFR敏感性突变患者的标准治疗方案[1]。
多个三期临床试验证实,与铂类化疗相比,第一代TKI和第二代TKI的中位缓解率为70-75%,无进展生存期(PFS)为10-14个月。第三代TKI奥西替尼在非小细胞肺癌的治疗中表现出更加优异的疗效,PFS和OS均有显著改善[2]。
然而,尽管在治疗方面取得了这些重大进展,但一些患者不可避免地会对EGFR-TKI产生耐药性,这将导致疾病进展,并最终影响患者的生存。因此,迫切需要开发新的策略来改善非小细胞肺癌患者的EGFR-TKI耐药性。
目前,越来越多的证据表明,治疗后残留的耐药持续性(DTP)肿瘤细胞在耐药诱导过程中起着重要作用,可通过多种机制(如转录、表观遗传学和代谢重编程)在初始治疗后存活,并在长期药物治疗后驱动不可逆的获得性耐药[3]。因此,靶向DTP细胞可能是改善患者耐药性和延长治疗反应的潜在策略。
近日,清华大学药学院胡泽平教授在《临床调查》杂志上发表了一项重要研究成果,阐述了DTP通过异常代谢调节参与TKI耐药治疗的机制。清华大学药学院的聂萌、陈钠和庞欢欢以及同济大学附属肺科医院的江涛是该论文的第一作者。
他们发现,EGFR-TKI疗法可以通过上调YAP介导的乙酰胆碱生物合成酶胆碱乙酰转移酶(ChAT)的表达,导致乙酰胆碱(ACh)的积累。乙酰胆碱通过WNT信号通路以乙酰胆碱毒蕈碱受体-3(M3R)依赖的方式介导药物耐受。
值得注意的是,EGFR-TKI与ACh/M3R信号抑制剂达非那新联合应用,可以提高小鼠对EGFR-TKI疗法的耐药性,为控制耐药性和改善NSCLC的治疗现状提供了一种潜在的联合治疗策略[4]。

报纸首页截图
首先,研究人员在体外将EGFR突变的人类NSCLC细胞系PC9和HCC827暴露于致死剂量的EGFR-TKIs,以诱导DTP细胞的产生。
然后通过靶向代谢组学比较亲代细胞和DTP细胞的代谢差异,发现来源于PC9和HCC827的DTP细胞中胆碱代谢产物的丰度发生了显著变化。与亲代细胞相比,乙酰胆碱(ACh)在DTP细胞中大量积累。
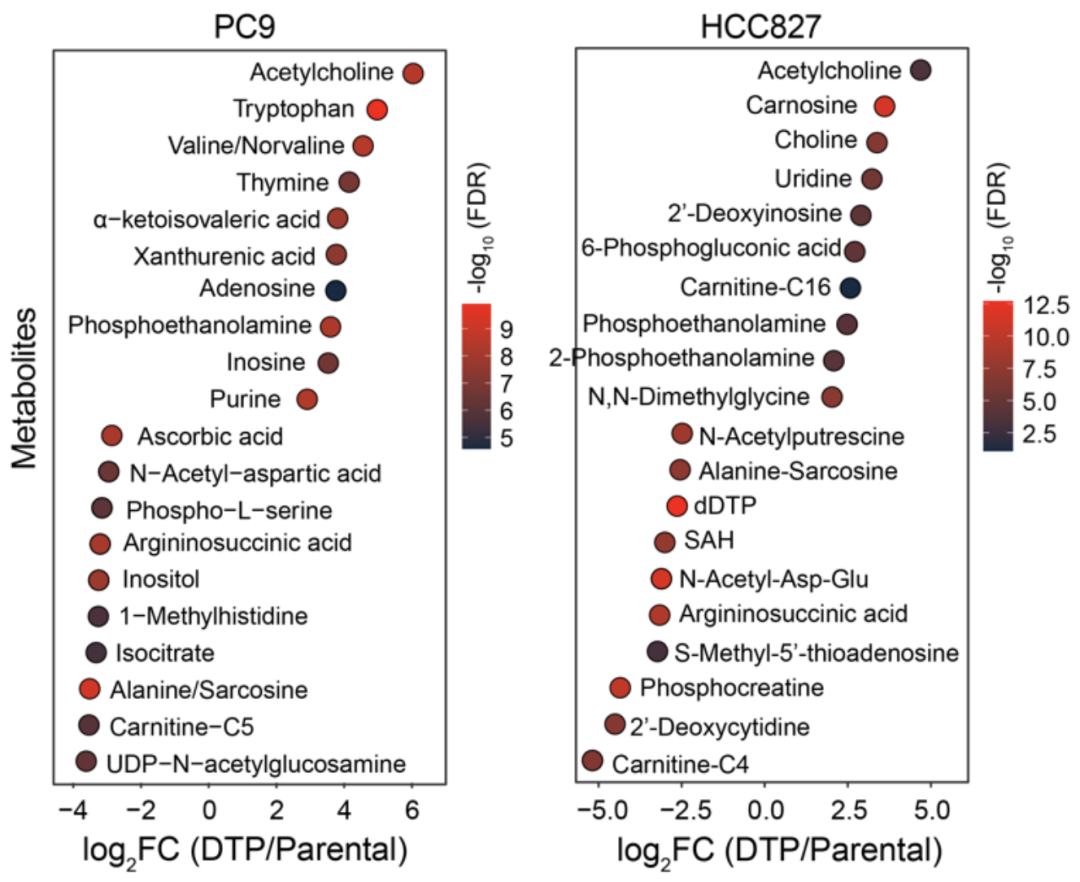
乙酰胆碱(ACh)在DTP细胞中大量积累。
同时,通过对亲代细胞和DTP细胞的转录组测序,发现DTP细胞和参与调节神经递质生物合成的基因表达增加。这表明乙酰胆碱代谢的重编程在诱导EGFR-TKI非小细胞肺癌耐药中起重要作用。
为了进一步验证上述发现,作者建立了非小细胞肺癌患者EGFR突变的异种移植瘤(PDX)模型,检测了乙酰胆碱代谢水平的变化,得到了类似的结论。
接下来,作者用奥西替尼处理PC9细胞11天,然后停药,继续培养14天,然后重新给药。结果发现停止给药后细胞对奥西替尼的敏感性恢复,重新给药后有一小批DTP细胞新生成。初始DTP细胞和再次给药后再生的DTP细胞中的乙酰胆碱水平较高,而亲代细胞和奥西替尼停药期细胞中的乙酰胆碱水平相对较低。
那么EGFR-TKI疗法是如何导致细胞内乙酰胆碱水平的变化的呢?
乙酰胆碱由胆碱和乙酰辅酶a通过限速酶ChAT合成,然后通过乙酰胆碱转运蛋白转运到突触小泡,分泌到细胞外环境中,与靶细胞上的烟碱型乙酰胆碱受体(nAChR)和毒蕈碱型乙酰胆碱酯受体(mAChR)结合,发挥其生物学作用。
为了阐明DTP细胞中乙酰胆碱积累的可能原因,作者评估了与乙酰胆碱代谢和信号转导相关的蛋白质表达,发现一种短ChAT亚型(41 kDa)的表达显著上调。
有趣的是,与EGFR-TKI处理引起的细胞中乙酰胆碱水平的动态变化一致,这种短ChAT异构体的表达也显示出可逆的动态变化。
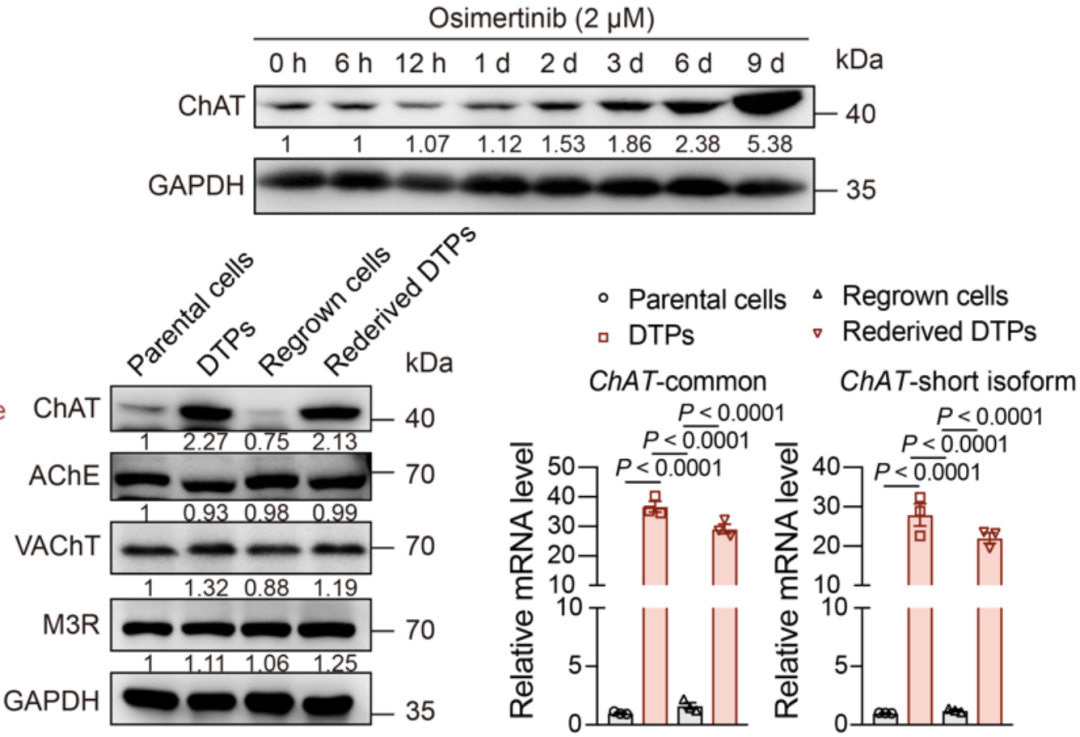
用查特基疗法,它表现出可逆的动态变化。
>接下来,作者试图确定EGFR-TKI上调短ChAT亚型表达的机制。
通过分析已有文献,作者发现YAP通路的激活,在肿瘤细胞逃避EGFR抑制剂治疗过程中发挥重要作用[5]。同时分析公共染色质沉淀测序(ChIP-seq)数据发现,在ChAT的远端调节区有三个潜在的YAP结合位点,依据这些可推测YAP可能通过结合远端增强子来调节ChAT转录。
实验结果也表明,奥希替尼治疗显著增加了ChAT增强子(#1和#3)上的YAP结合。同时YAP敲除导致增强子(#1和#3)的荧光素酶报告活性显著降低。进一步,YAP敲除在mRNA和蛋白质水平显著降低了奥希替尼诱导的短CHAT亚型的上调。此外,奥希替尼诱导的乙酰胆碱累积也被YAP敲除减弱。
这些发现表明,EGFR-TKI可通过YAP介导的转录激活上调ChAT表达,进一步导致Ach的累积。
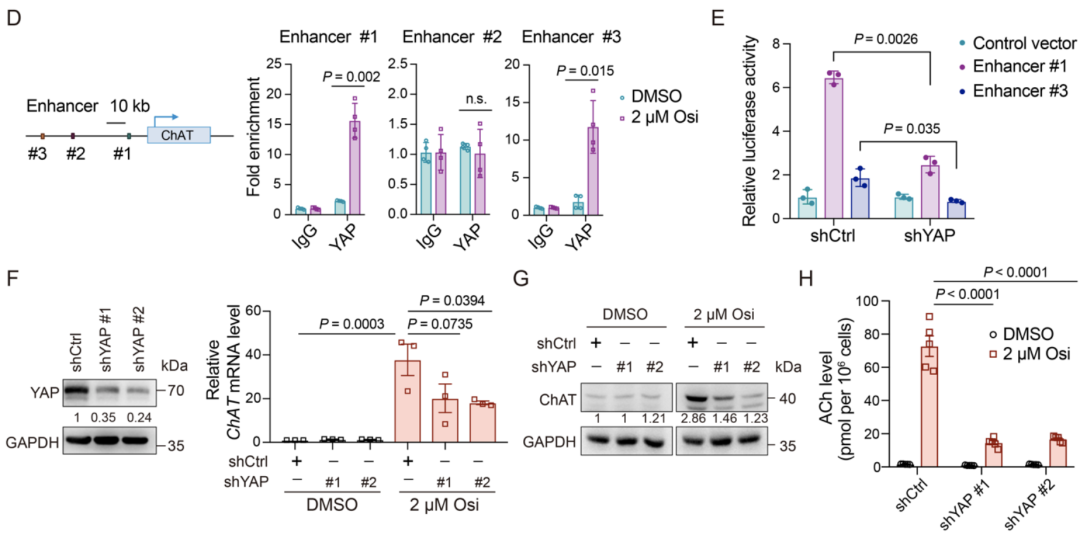
YAP介导ChAT的表达上调
基于上述实验结果,作者推断或许可以通过干预乙酰胆碱产生、分泌或乙酰胆碱信号传导,来调节肿瘤对于药物的耐受性。
首先,作者发现外源性乙酰胆碱的处理可促进DTP的形成,并降低PC9和HCC827细胞对奥希替尼的敏感性。
进一步研究发现,短ChAT亚型的表达水平与奥希替尼敏感性之间也存在正相关关系。在奥希替尼治疗后,与ChAT水平低的单细胞克隆相比,ChAT水平高的单细胞克隆DTP形成更多。此外,短ChAT亚型的过表达也导致乙酰胆碱水平显著增加,并显著增加DTP的形成和药物耐受性,进一步导致更快速的肿瘤复发。
相反,奥希替尼诱导的乙酰胆碱增加可被ChAT敲除阻断,同时,ChAT敲除显著抑制了DTP细胞的形成,增强了对奥希替尼的药物敏感性,抑制肿瘤复发,改善生存结果。这种效应可通过补充外源性乙酰胆碱而得以挽救。
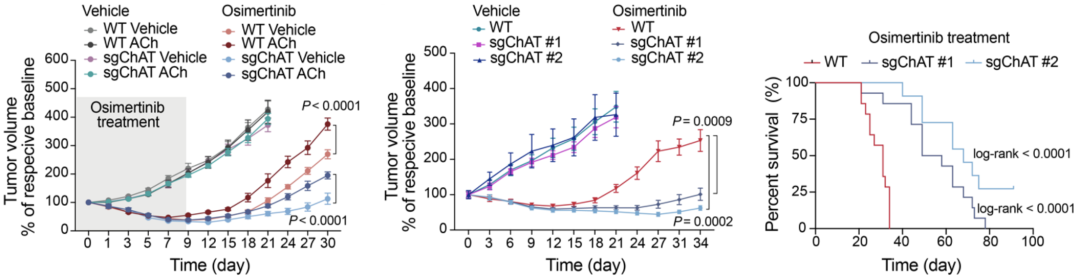
敲除ChAT导致肿瘤耐药性的降低
Darifenacin一种M3R抑制剂,使用其处理可显著降低DTP细胞形成。奥希替尼和Darifenacin的联合治疗可改善肿瘤细胞对奥希替尼的耐受性,这些证据均证明了乙酰胆碱代谢和信号传导在介导药物耐受形成中的重要作用。
在以上基础上,作者进一步通过体内实验探索了Darifenacin在肿瘤治疗中的潜在应用价值。在注射PC9细胞后14天,对小鼠单独使用Darifenacin、单独使用奥希替尼或使用奥希替尼和Darifenacin联合治疗。
单独使用奥希替尼,以及奥希替尼和Darifenacin的联合治疗,在9天内使肿瘤显著消退。为了评估Darifenacin对肿瘤复发的特异性影响,第9天后停止奥希替尼治疗。与单独接受奥希替尼的小鼠相比,联合治疗的小鼠在停止奥希替尼治疗后显示出延迟的肿瘤复发。
进一步,在PC9异种移植小鼠接受单独奥希替尼的初始治疗9天,将小鼠随机分为两组:一组单独用奥希替尼治疗,另一组给予奥希替尼与Darifenacin联合治疗。与单独使用奥希替尼治疗相比,联合使用奥希替尼和Darifenacin治疗时,奥希消退的残留肿瘤复发率显著降低。此外,与单独给予奥希替尼的小鼠相比,给予联合治疗的小鼠具有显著改善的生存结果。
总之,这些体内结果表明,EGFR-TKI和ACh/M3R抑制药物联合治疗可以减少残留肿瘤的形成并延缓肿瘤复发。
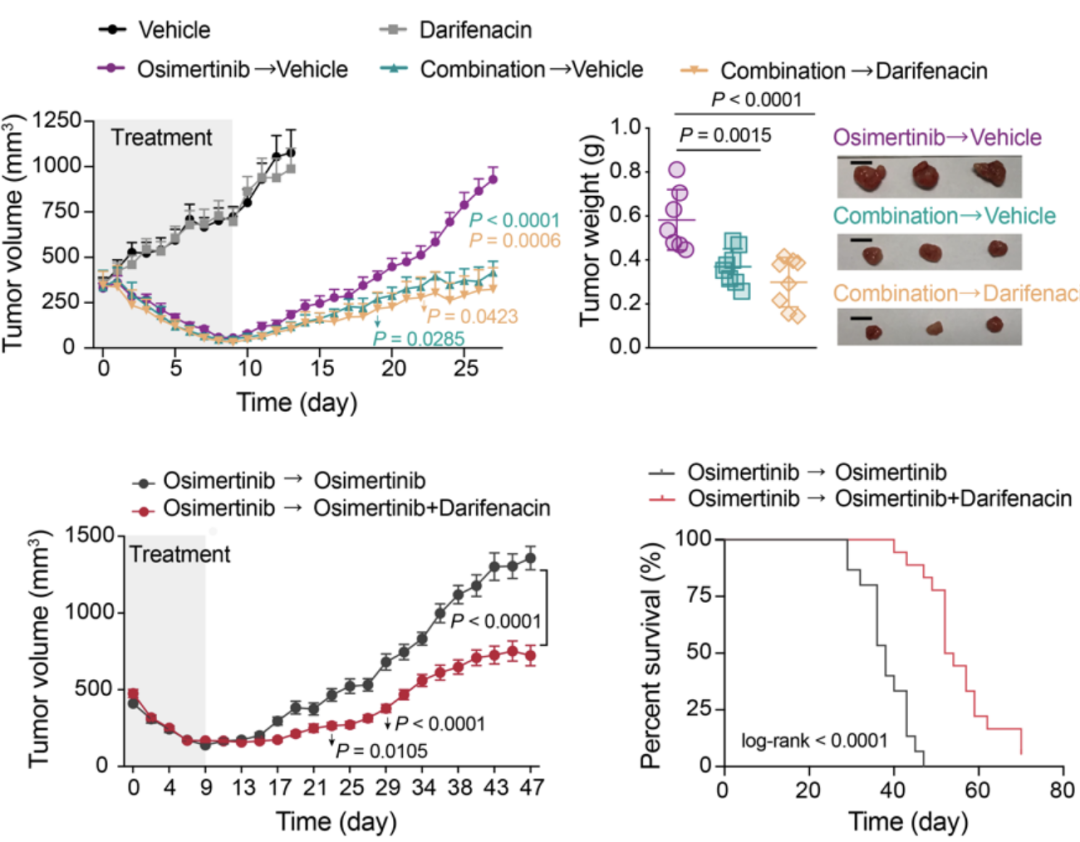
EGFR-TKI和ACh/M3R抑制药物联合治疗可以减少残留肿瘤的形成并延缓肿瘤复发
那么乙酰胆碱是如何驱动肿瘤对于TKI药物耐受的呢?
作者回顾了来自亲代PC9细胞和PC9衍生的DTP细胞的RNA测序数据,发现一些WNT信号分子在DTP细胞中上调,而WNT信号通路的几种负调控因子表达下调。因此,作者认为乙酰胆碱可能通过激活WNT信号传导来调节药物耐受。
进一步研究发现,添加WNT信号激动剂CHIR99021或WNT3A后,显著降低了Darifenacin减少DTP形成的能力。相反,与单独的Darifenacin治疗相比,与WNT信号抑制剂LGK974和ICG-001联合使用可进一步抑制DTP的形成。
总之,这些发现证实EGFR-TKI诱导的乙酰胆碱增加,可通过激活WNT信号传导介导药物耐受的出现。
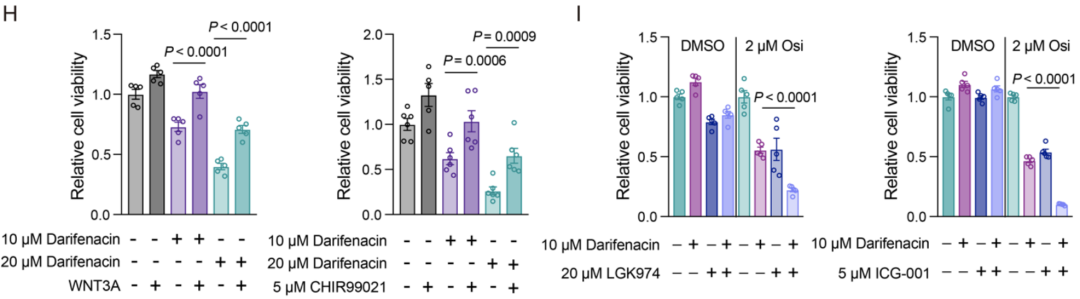
EGFR-TKI诱导的乙酰胆碱增加可通过激活WNT信号传导介导药物耐受的出现
最后,作者探索了患者血浆ACh水平是否与对EGFR-TKIs的临床反应相关。由此设计了一项队列研究,分析EGFR突变的NSCLC患者(n=78)治疗前血浆ACh水平。
根据治疗前的基线ACh水平,将患者分为低表达组、中间组和高表达组。低ACh水平患者的EGFR TKI应答率相对较高(84%),而高和中ACh水平的患者的应答率相对较低(分别为58%和63%),表明患者治疗前血浆ACh水平可能与临床应答率呈负相关。
此外,与治疗前ACh水平较低和/或中等的患者相比,治疗前高ACh水平的患者显示出较短的无进展生存期。
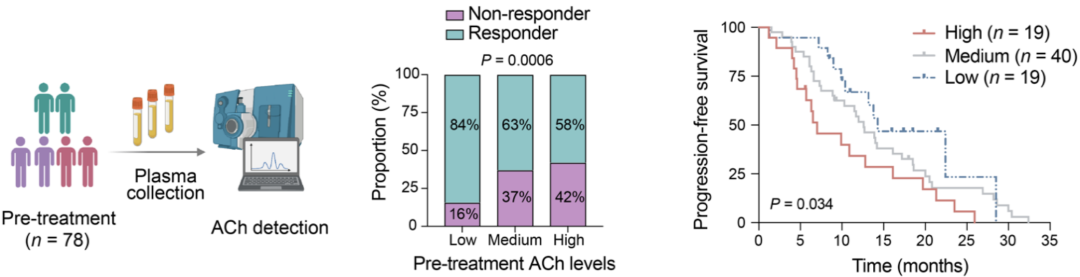
EGFR-TKI前血浆ACh水平高与不良反应高度相关
总之,通过这项研究,确定了NSCLC患者中EGFR-TKI诱导的ACh代谢重编程途径,为评估NSCLC对于EGFR-TKI的治疗效果,改善EGFR-TKI治疗耐药,提升治疗效果提供了潜在的策略。但仍需要通过前瞻性随机临床试验证明其在临床治疗中的有效性和安全性。
参考文献:
[1]Hirsch FR, Scagliotti GV, Mulshine JL, et al. Lung cancer: current therapies and new targeted treatments[J]. Lancet, 2017, 389 (10066):299-311. DOI:10.1016/s0140-6736(16)30958-8.
[2]Passaro A, J nne PA, Mok T, et al. Overcoming therapy resistance in EGFR-mutant lung cancer[J]. Nat Cancer, 2021, 2 (4):377-391. DOI:10.1038/s43018-021-00195-8.
[3]Oren Y, Tsabar M, Cuoco MS, et al. Cycling cancer persister cells arise from lineages with distinct programs[J]. Nature, 2021, 596 (7873):576-582. DOI:10.1038/s41586-021-03796-6.
[4]Nie M, Chen N, Pang H, et al. Targeting acetylcholine signaling modulates persistent drug tolerance in EGFR-mutant lung cancer and impedes tumor relapse[J]. J Clin Invest, 2022. DOI:10.1172/jci160152.
[5]Kurppa KJ, Liu Y, To C, et al. Treatment-Induced Tumor Dormancy through YAP-Mediated Transcriptional Reprogramming of the Apoptotic Pathway[J]. Cancer Cell, 2020, 37 (1):104-122.e112. DOI:10.1016/j.ccell.2019.12.006.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- JAMA:管住嘴、迈开腿,脑更灵!临床3期试验表明,坚持两年改善生活方式可显著改善老年人认知,加以监督、提高强度获益更多 (2025-08-01)
- 艾伯维2025H1:自免双子星116亿美元,FRα ADC增长76% (2025-08-01)
- 鹏瑞利集团、陆家嘴管理局和陆家嘴集团签订三方合作战略协议 拟设立上海首家外商独资三级综合医院 (2025-07-31)
- 为什么女朋友/老婆总爱改主意或纠结?最新Sci Adv:大脑中LINC00473对女性影响显著,使其敏锐地权衡沉没成本和风险收益 (2025-07-31)
- PLoS Comput Biol:人体生物钟在较高温下通过扭曲基因活动来保持24小时的节律 (2025-07-31)
- 喝含糖饮料竟会“改写”肠道细菌 DNA?Nat Commun:软饮料会影响肠道细菌和免疫系统之间的交流 (2025-07-31)
- Cell:指出一篇与冠状病毒抗病毒药物开发相关的研究存在缺陷 (2025-07-30)
- 《科学》:糖尿病治疗重大突破!科学家开发新型分子胶,可将RAS与PI3K亲和力提高500倍,无需胰岛素也可降糖 (2025-07-30)
- 打破昼夜节律局限!Nat Neurosci:CLOCK 基因揭秘人类大脑认知超凡进化的关键密码 (2025-07-30)
- ACS Nano:浙江大学研究发现,人类卵泡液和精浆中存在纳米塑料,影响受精能力和精子质量 (2025-07-30)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















