多发性骨髓瘤新药(MM)!FDA授予BCMAxCD3双特异性抗体elranatamab为突破性疗法! |
 |
来源:100医疗网原创2022-11-08 10336050
除了BTD,elranatamab还被FDA和EMA授予治疗多发性骨髓瘤(MM)的孤儿药资格(ODD)。FDA和EMA也分别授予了elranatama治疗RRMM的快速通道资格。
2022年11月05日/Bioon/-辉瑞公司最近宣布,美国美国食品药品监督管理局()授予BCMAxCD3双特异性抗体(BsAb)elranatamab(PF-06863135)作为突破性治疗鉴定(BTD):用于治疗复发或难治性多发性骨髓瘤患者(RRMM)。
BTD是FDA于2012年设立的新药评估通道,旨在加快用于治疗严重或危及生命疾病的新药的开发和审查,并有初步的临床证据表明,与现有的治疗药物相比,它们可以实质性地改善病情。具有BTD的药物在研发过程中可以更紧密地接受FDA高级官员的指导,在评审时有资格进行滚动评审和潜在的优先评审,从而在最短的时间内为患者提供新的治疗方案。
双特异性抗体(BsAb)是一种新型的癌症治疗方法,它可以同时结合两个不同的靶点。一只手臂直接与癌细胞上的特定抗原结合,另一只手臂激活患者自身免疫系统中的T细胞,使其靠近癌细胞以杀死它。
Elranatamab旨在结合多发性骨髓瘤细胞表面高表达的B细胞成熟抗原(BCMA)和T细胞表面的CD3受体,将二者桥接在一起,激活T细胞杀死骨髓瘤细胞。Elranatamab对BCMA和CD3的结合亲和力被优化以刺激有效的T细胞介导的抗骨髓瘤活性。Elranatamab皮下给药,比静脉注射更方便,并可能降低潜在不良事件的风险,如细胞因子释放综合征(CRS)。
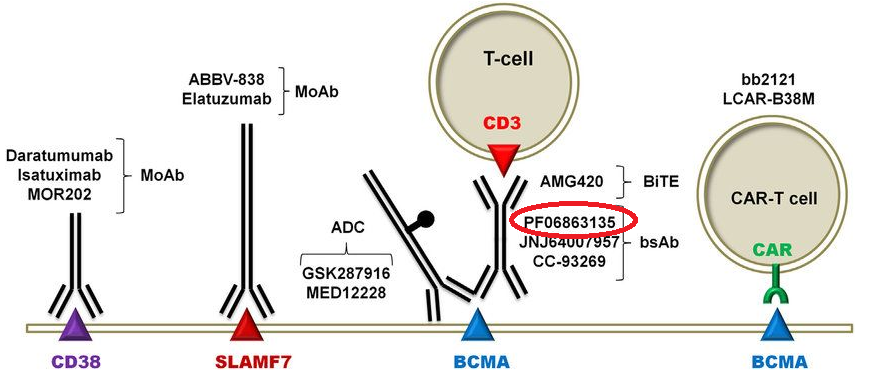
多发性骨髓瘤细胞表面的有效生物治疗靶点(图片来自文献:PMID:30545798)
除了BTD,elranatamab还被FDA和EMA授予治疗多发性骨髓瘤(MM)的孤儿药资格(ODD)。FDA和EMA也分别批准了针对RRMM治疗的elranatama快速通道资格(FTD)和优先药物资格(PRIME)。
基于MagnetisMM-3研究队列A(n=123)的6个月随访数据,FDA授予elranatamab。这是一项开放性、多中心、单组、2期研究,旨在评估RRMM患者接受elranatamab单药治疗的安全性和有效性。在该研究中,患者接受每周一次(QW)皮下注射(SC)elranatamab 76mg,并在第一周给予2步启动剂量方案。
结果显示,elranatamab具有可管理的安全性,在6.8个月的中位随访时,总缓解率(ORR)为61.0%。缓解期患者中,维持缓解6个月的概率为90.4%。不考虑因果关系,治疗期间最常见的不良事件(TEAE)是CRS(57.9%),大多数报告的事件为1级(43.2%)或2级(14.2%)。(100yiyao.com 100医疗网)
原始来源:
版权声明
本网站所有标注“来源:100医学网”或“来源:bioon”的文字、图片及音视频资料,版权归100医学网网站所有。未经授权,任何媒体、网站、个人不得转载,否则将追究法律责任。获得书面授权转载时,必须注明“来源:100医学网”。其他来源的文章均为转载文章。本网站所有转载文章都是为了传递更多信息。转载内容不代表本站立场。不想被转载的媒体或个人可以联系我们,我们会立即删除。
87%的用户都在使用100医疗网APP随时阅读、评论、分享、交流。请扫描二维码下载-


- 相关报道
-
- NEJM:人工视网膜,帮助老年性黄斑变性患者恢复视力 (2025-10-25)
- 华中师范大学最新Cell子刊论文:开发治疗白血病的多肽类药物 (2025-10-25)
- 《科学》:膳食脂肪重塑昼夜节律!加州大学科学家发现,饮食中不饱和脂肪酸比例会影响昼夜节律,是人体生物钟与季节匹配与否的关键 (2025-10-25)
- 河南中州实验室发表Nature Metabolism论文:揭开大脑髓鞘再生修复的关键 (2025-10-25)
- Nature Medicine:为疲惫的心脏“重启引擎”——基因疗法AB-1002能否逆转心力衰竭的宿命? (2025-10-25)
- 槲皮素哪个牌子好?槲皮素品牌前十名:肺结节该怎么选? (2025-10-25)
- 西安多欧信息咨询 :深耕医疗赛道,以全案服务赋能行业创新 (2025-10-24)
- 便秘药物最新推荐 (2025-10-24)
- 叶酸什么牌子口碑最好 (2025-10-24)
- 加科思药业在AACR-NCI-EORTC国际大会公布泛KRAS抑制剂(JAB-23E73)临床前数据 (2025-10-24)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















