新靶点+新载体:黎松团队通过siRNA联合化疗,增强抗肿瘤免疫反应 |
 |
来源:生物世界 2022-12-02 13:27
这项研究发现铂类药物能显著诱导肿瘤细胞表达促翻转酶Xkr8的表达,进而开发了一种新型纳米载体PMBOP-CP,它可以特异性靶向肿瘤组织,同时递送铂类药物和Xkr8-siRNA乒乓球是中国的国球,为中国带来了无数的荣誉,想要打好乒乓球,正确运用球拍两面的正胶与反胶是其中关键,这样才能精确控制乒乓球的运动轨迹和旋转方向。
有趣的是,癌细胞也深谙 乒乓绝技 ,它们通过翻转细胞膜的磷脂酰丝氨酸(phosphatidylserine,PS),在细胞膜上产生类似于 正胶与反胶 的效果,以此应对系统的疯狂 扣杀 。因此,如果我们能控制癌细胞膜上的PS的翻转,就能开发出一种新型癌症免疫疗法,为广大癌症患者带来新的希望。
美国匹兹堡大学黎松教授团队联合卢斌峰教授在 Nature Nanotechnology 期刊发表了题为:Targeting Xkr8 via nanoparticle-mediated in situ co-delivery of siRNA and chemotherapy drugs for cancer immunochemotherapy的研究论文。
该研究发现,肿瘤细胞中的促翻转酶(scramblase)Xkr8在铂类化疗药物治疗后显著高表达,并基于此开发了一种能共载铂类化疗药物和Xkr8-siRNA的新型纳米载体 PMBOP-CP。该载体在体内能高效靶向肿瘤细胞、阻断磷脂酰丝氨酸(PS)翻转,显著抑制和模型中的肿瘤生长。


黎松教授
该论文的通讯作者黎松教授表示,这项研究与两个创新之处:一个是发现了新的治疗靶点,另一个是开发了新的纳米载体,这种纳米载体在在免疫疗法和化疗药物的选择性递送方面非常有效。这项研究令人兴奋,因为它具有很高的转化价值和应用潜力。
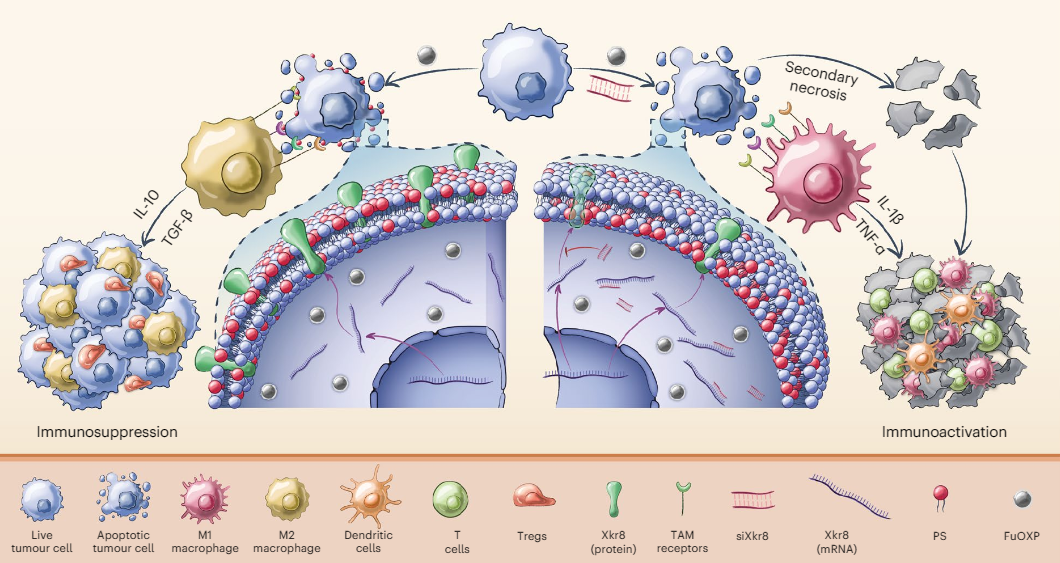
磷脂酰丝氨酸(PS)是一类普遍存在于哺乳动物细胞中的磷脂,作为膜结构的重要组成部分,PS通常仅分布于细胞膜磷脂双分子层的内侧。然而,在细胞凋亡过程中,内侧的PS会被暴露在磷脂双分子层的外侧,这个由内而外的翻转过程依赖PS促翻转酶(scramblase) Xkr8。
值得注意的是,在癌症治疗过程中,常规放化疗会使PS在肿瘤细胞凋亡时被Xkr8不可逆地外翻。外翻的PS会与免疫细胞上的受体结合,引起严重的免疫抑制,从而使得放化疗的临床效果大打折扣。因此,抑制Xkr8或许是一种改善肿瘤微环境、达到更好治疗效果的新途径。
在这项最新研究中,研究团队首先发现,经铂类化疗药物治疗后,癌细胞系和小鼠肿瘤中的促翻转酶Xkr8在转录和蛋白水平上均显著增加。由于目前尚无Xkr8的小分子抑制剂,研究人员开发了一种新型纳米载体PMBOP-CP,用于小鼠肿瘤模型中Xkr8-siRNA和铂类药物(FuOXP)的共递送。
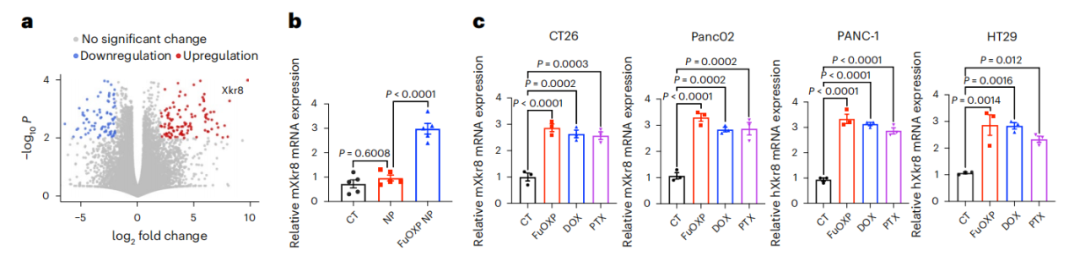
铂类药物治疗促进Xkr8的转录和表达
PMBOP聚合物具有两亲性:其脂质链能帮助铂类药物更有效地加载到疏水核心中,并促进聚合物与细胞膜的融合;其阳离子双胍基团能增强与siRNA形成的离子相互作用,从而使siRNA稳定地结合在聚合物表面。
众所周知,具有阳离子表面的药物载体不适合全身递送到远处实体肿瘤。因此,为了适用于静脉注射,研究团队还是用了带有大量负电的硫酸软骨素(CS)和聚乙二醇化-CS(PEG-CS)的混合物包覆PMBOP聚合物表面,最终形成了PMBOP-CP纳米载体。
值得一提的是,CS是CD44(在各类肿瘤细胞及肿瘤内皮细胞上有很高的表达)的一种重要天然配体。通过调节PMBOP、CS和PEG-CS的比例,不仅可以中和载体表面的正电荷,还能靶向肿瘤细胞。
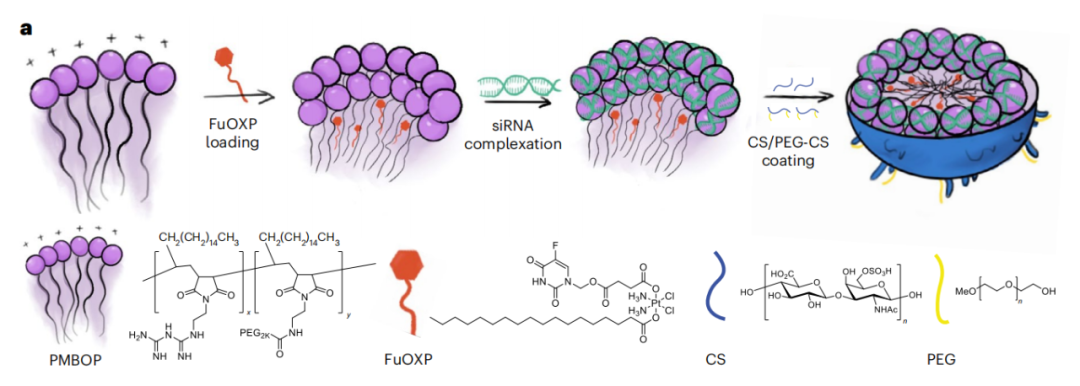
新型纳米载体 PMBOP-CP的制备流程
基于上述提到的这些要点,研究团队通过一系列的筛选确定了PMBOP-CP纳米载体各组分的最优比例,在静脉给药后,小鼠肿瘤中铂的浓度随着时间的推移而增加,且肿瘤中的铂浓度比肝脏高约3.7倍。更重要的是,PMBOP-CP纳米载体不仅对超过5种不同类型的皮下肿瘤模型有靶向作用,在原位肿瘤和肺部转移灶中也有很高的累积。
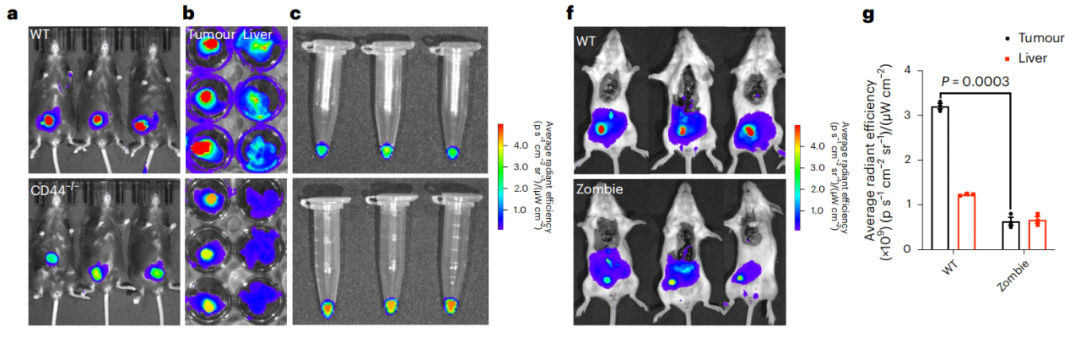
PMBOP-CP具有肿瘤组织靶向性
与预期一致,PMBOP-CP纳米载体将Xkr8-siRNA递送到肿瘤细胞中,降解了Xkr8的mRNA,降低了Xkr8的蛋白水平,从而明显减少了肿瘤细胞膜外表面磷脂酰丝氨酸的含量。不仅如此,研究人员还发现,在肿瘤细胞与巨噬细胞的共培养实验中,Xkr8-siRNA可以阻断免疫抑制类细胞因子IL-10的分泌,并诱导巨噬细胞向M1群体(免疫激活表型)的分化。
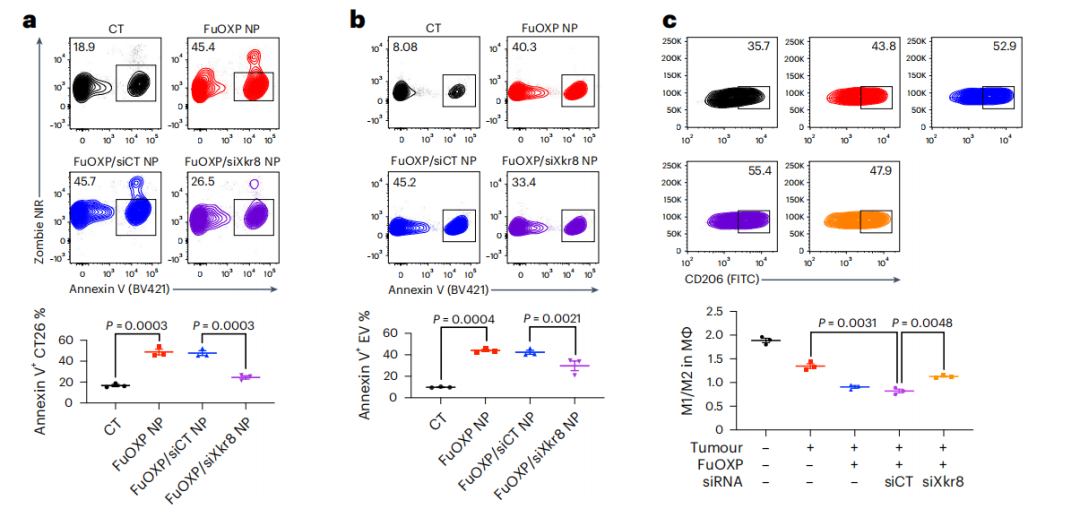
Xkr8-siRNA诱导巨噬细胞的M1极化
最后,研究团队利用PMBOP-CP纳米载体给药结肠癌/胰腺癌小鼠模型,以测试联合用药方案的治疗效果。研究人员发现,相较于单个递送,同时递送铂类药物和Xkr8-siRNA,既能明显减缓小鼠肿瘤的生长速度,又能显著改善肿瘤微环境,大幅增加淋巴细胞、功能性T细胞、M1型巨噬细胞等抗细胞的浸润,增强免疫系统对肿瘤细胞的杀伤作用。
研究模式图
在安全性方面,小鼠对静脉注射PMBOP-CP纳米载体具有良好的耐受性,其在体重、肝肾功能以及几个主要器官的正常组织学等指标均表现正常,证实了PMBOP-CP纳米载体在体内实验中的安全性。
总而言之,这项研究发现铂类药物能显著诱导肿瘤细胞表达促翻转酶Xkr8的表达,进而开发了一种新型纳米载体PMBOP-CP,它可以特异性靶向肿瘤组织,同时递送铂类药物和Xkr8-siRNA,阻断磷脂酰丝氨酸外翻,显著抑制结肠癌和胰腺癌的发展,预示着癌症免疫治疗的新方向。
鉴于他们的目标是将他们的新疗法转化为临床,该团队现在正在寻求通过额外的实验来验证他们的发现,并进一步评估潜在的副作用。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- NEJM:人工视网膜,帮助老年性黄斑变性患者恢复视力 (2025-10-25)
- 华中师范大学最新Cell子刊论文:开发治疗白血病的多肽类药物 (2025-10-25)
- 《科学》:膳食脂肪重塑昼夜节律!加州大学科学家发现,饮食中不饱和脂肪酸比例会影响昼夜节律,是人体生物钟与季节匹配与否的关键 (2025-10-25)
- 河南中州实验室发表Nature Metabolism论文:揭开大脑髓鞘再生修复的关键 (2025-10-25)
- Nature Medicine:为疲惫的心脏“重启引擎”——基因疗法AB-1002能否逆转心力衰竭的宿命? (2025-10-25)
- 槲皮素哪个牌子好?槲皮素品牌前十名:肺结节该怎么选? (2025-10-25)
- 西安多欧信息咨询 :深耕医疗赛道,以全案服务赋能行业创新 (2025-10-24)
- 便秘药物最新推荐 (2025-10-24)
- 叶酸什么牌子口碑最好 (2025-10-24)
- 加科思药业在AACR-NCI-EORTC国际大会公布泛KRAS抑制剂(JAB-23E73)临床前数据 (2025-10-24)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















