专访天津医科大学余秋景教授:PHGDH基因与丝氨酸代谢功能新发现 |
 |
来源:赛业生物 2022-12-21 13:40
当然除了限制饮食之外,药物处理也能够起到类似的效果。可以研发针对PHGDH的抑制剂,事实上已经开发出许多种特定肿瘤细胞PHGDH酶的抑制剂近日,天津医科大学基础医学院系/天津市免疫学研究所余秋景教授团队在Cellular & Molecular Immunology期刊发表了题 为:Serine Metabolism Orchestrates Macrophage Polarization by Regulating the IGF1-p38 Axis的研究论文。

该研究解析了磷酸甘油脱氢酶(PHGDH)及丝氨酸代谢调控巨噬细胞极化及其在抗作用的新发现,赛业生物俞晓峰博士就此研究最新成果,特别是该研究中对PHGDH基因未知功能的创新探索研究方面,对余秋景教授进行了专访。
俞晓峰博士:巨噬细胞的极化(比如M1巨噬细胞与M2巨噬细胞间两级分化)作用在抗感染及抗肿瘤作用机制研究方面非常热门,余老师在研究中提出将丝氨酸代谢与巨噬细胞的极化作用联系在一起的假设,是以哪些前期相关研究工作为基础的?
余秋景教授:巨噬细胞激活到不同极化状态,可在包括宿主防御、炎症、和肿瘤的发展等过程中执行不同的功能。在肿瘤发展初期也就是急性炎症期,大多数免疫细胞可杀灭病原、促进组织修复和阻止肿瘤生长;并且利用刺激物和炎性因子激活免疫系统,进而发挥抑癌的作用。其中巨噬细胞可由IFN 、TNF- 和IL-1等多种细胞因子和/或细菌脂多糖等病原相关分子模式(PAMPs),HMGB1等损伤相关的分子模式(DAMPs)经典激活成M1巨噬细胞, 表达诱导型一氧化氮合酶与IL-6、IL-1 和TNF- 等促炎细胞因子,表现出杀菌、促炎和抗肿瘤功能。
如果急性炎症反应不能及时消退,就会转化为慢性炎症,慢性炎症产生的细胞因子通过改变癌基因和抑癌基因表达、诱导癌基因和抑癌基因突变和转化、诱导新生,抑制细胞凋亡,募集多种免疫抑制性细胞(如MDSC、Treg等)促进免疫抑制肿瘤微环境(TME)的建立,促进肿瘤的发生和发展。其中巨噬细胞由IL-4,IL-10,TGF 和乳酸等替代激活成M2巨噬细胞,产生精氨酸酶1(ARG1)、抵抗素样 (Retn1a)、巨噬细胞半乳糖型凝集素1和抗炎细胞因子如IL-10。因此,M2巨噬细胞执行组织修复、抗炎和促肿瘤功能。肿瘤相关巨噬细胞(TAM)被认为大多数属于M2激活的范围,因为它们具有抗炎、免疫抑制和组织重塑效应。
巨噬细胞的激活与细胞代谢的变化密切相关。在巨噬细胞激活过程中,各种代谢通路被重新编程以适应细胞功能的变化,从而促进专门的免疫表型。某些最早发生的氨基酸的代谢改变是定义巨噬细胞类型最重要的特征,如L-精氨酸在M1巨噬细胞中被iNOS转化为NO,在M2巨噬细胞中被ARG1代谢。此外,谷氨酰胺已被证明可以通过产生 -酮戊二酸而协调巨噬细胞极化。然而,其他氨基酸的新陈代谢是否对在微调巨噬细胞中极化有作用,在很大程度上是未知的。
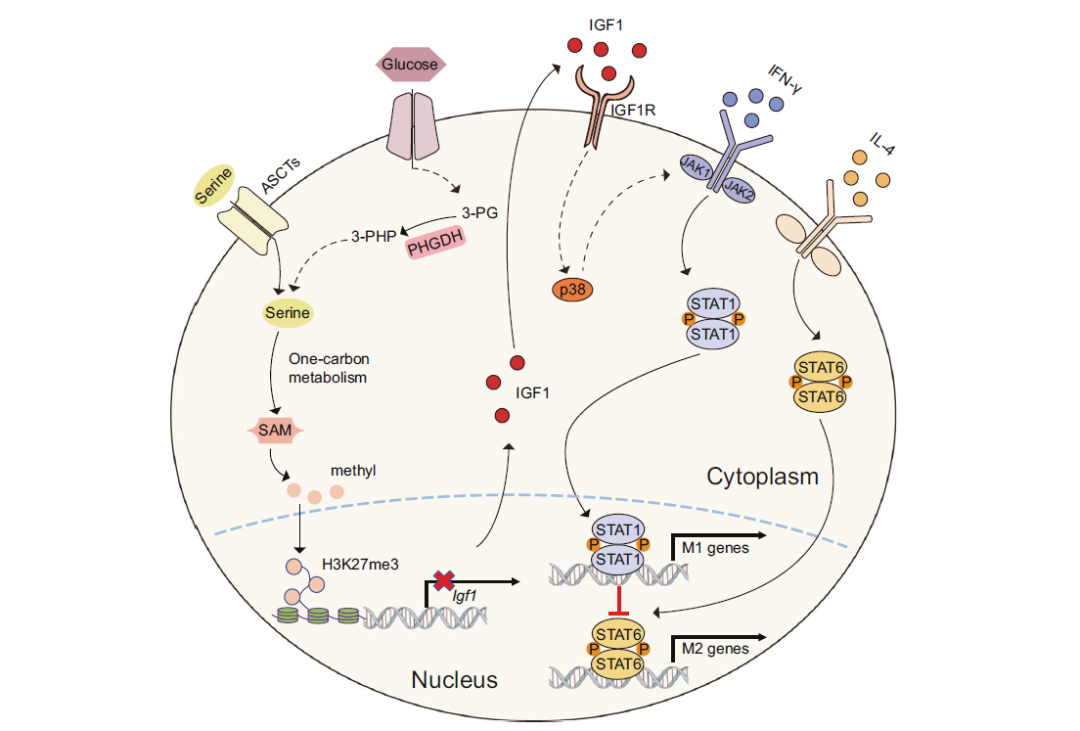
我们的研究发现,抑制丝氨酸生物合成途径中的关键酶磷酸甘油脱氢酶(PHGDH)的活性或通过限制外源性丝氨酸和甘氨酸的摄取来抑制丝氨酸代谢,在体外和体内都能增强IFN 激活的巨噬细胞M(IFN- )的极化,并抑制IL-4激活的巨噬细胞M(IL-4)的极化。机制实验表明,丝氨酸代谢不足可通过减少启动子上依赖S-腺苷甲硫氨酸(SAM)的组蛋白H3赖氨酸27三甲基化(H3K27me3)丰度来增加IGF1的表达。然后IGF1激活p38依赖的JAK-STAT1轴,促进M(IFN- )极化,抑制STAT6介导的M(IL-4)激活。该研究揭示了丝氨酸代谢调节巨噬细胞极化的新机制,并提示丝氨酸代谢的调控可作为巨噬细胞介导的免疫疾病的治疗策略。
俞晓峰博士:余老师通过体内外研究结果表明,磷酸甘油脱氢酶(PHGDH)基因表达有助于M2巨噬细胞的极化作用,抑制M1巨噬细胞极化作用。一般情况下,M1巨噬细胞具有促炎抗肿瘤作用,而M2巨噬细胞则具有抗炎促肿瘤作用。根据PHGDH基因在调控巨噬细胞极化方面所发挥的影响作用,还请余老师与我们分析PHGDH基因潜在基本功能?
余秋景教授:要解释PHGDH,就要从丝氨酸开始说起。丝氨酸是一种非必需氨基酸,可以参与细胞增殖。丝氨酸既可以从头合成,也可以从微环境中摄入。在从头合成过程中,糖酵解衍生的3-磷酸甘油酸(3-PG)最终可以通过一系列的酶促反应转化为丝氨酸,其中第一个关键步骤是由PHGDH催化3-磷酸甘油酸氧化为3-磷酸氧基丙酮酸。丝氨酸促进一个相互连接的代谢途径网络一碳代谢,通过一碳单位的转移促进核苷酸、S-腺苷蛋氨酸(SAM)、还原的烟酰胺腺嘌呤二核苷酸磷酸(NADPH)、以及谷胱甘肽(GSH)的生物合成。丝氨酸衍生的一碳代谢不仅支持癌症和T细胞增殖的核苷酸合成,还可通过GSH合成或SAM介导的组蛋白甲基化促进脂多糖(LPS)诱导巨噬细胞产生IL-1 。
文献表明PHGDH具有多种酶活性及催化功能,当然除催化3-磷酸甘油酸外,PHGDH还可以产生除丝氨酸以外的代谢物,PHGDH可使 -酮戊二酸还原成D-2HG,D-2HG是异柠檬酸脱氢酶(IDH)突变后产生的一种肿瘤细胞代谢产物,D-2HG可以对肿瘤细胞本身产生调节作用,也可以使细胞向癌变方向转化,这也部分解释了PHGDH高表达时其致癌功能。PHGDH 还可催化(S)-苹果酸氧化为草酰乙酸酯。研究发现PHGDH可通过上调目标促癌基因,以非代谢方式促进某些肿瘤的生长。此外,PHGDH还可增强肿瘤细胞对氧化应激的抵抗力,这反过来可能与肿瘤细胞增强的转移特性有关。
俞晓峰博士:PHGDH作为丝氨酸生物合成的关键酶,在揭示丝氨酸代谢作用机制的研究中,我们注意到余老师应用Phgdh fl/fl x Lyz2-Cre小鼠实现在髓系单核巨噬细胞细胞中特异性敲除小鼠Phgdh基因,验证了该基因对巨噬细胞极化及丝氨酸代谢介导作用至关重要,余老师也通过体外在相关细胞系中过表达PHGDH的方式证实其相关作用,余老师有没有考虑过在小鼠体内过表达PHGDH基因,从另外一个方面验证PHGDH基因的功能?
余秋景教授:目前已知的文献,据我所知,动物模型大多数为PHGDH全身敲除和组织特异性敲除PHGDH的小鼠模型。在小鼠体内过表达PHGDH是否能验证PHGDH基因的功能,是一个值得考虑的问题。如果从PHGDH在丝氨酸从头合成中重要的酶促作用出发,PHGDH过表达在有不同丝氨酸浓度的器官组织中的作用很可能不同。譬如,由于饮食中的丝氨酸不能有效通过血脑屏障,大脑中的丝氨酸浓度较低,脑细胞较依赖丝氨酸的从头合成。
以往临床和小鼠实验的科研成果显示PHGDH的神经系统突变或者表达减少造成包括脑萎缩和癫痫发作等大脑病症。最近一篇发表在Cell Metabolism上题为:PHGDH expression increases with progression of Alzheimer s disease pathology and symptoms的论文揭示了与年龄和性别匹配的对照组大脑相比,阿尔茨海默病患者的四个人类队列和两种阿尔茨海默病小鼠模型中的PHGDH mRNA和蛋白水平都有所增加。人脑中PHGDH表达的增加与阿尔茨海默病症状的发展和病理程度密切相关。因此探索PHGDH 在小鼠中的脑中过表达对某些大脑发育和退行性疾病的发生发展可能是有意义的工作。
俞晓峰博士:应用髓系单核巨噬细胞特异性Phgdh敲除小鼠抗肿瘤形成实验证实,该基因敲除具有抑制肿瘤细胞系(比如LLC小鼠细胞)在小鼠体内生长的作用,记得余老师以前也有应用Phgdh特异性敲除的小鼠模型,揭示了该基因在抗病毒感染方面的相关作用机制,能否也请余老师在此也与我们简单分享一下?
余秋景教授:先天免疫是宿主抵御外界感染的第一道重要防线,抗病毒先天免疫如何受到宿主代谢活动的影响是一个有待研究的有趣问题。前期研究发现和葡萄糖代谢网络可以共同调控抗病毒先天免疫的激活,但其他宿主代谢活动(如氨基酸代谢等)是否以及如何影响抗病毒先天免疫在很大程度上尚待阐明。
带着这个问题出发,我们研究团队首先检测了病毒感染后巨噬细胞中丝氨酸、甘氨酸、一碳代谢相关基因的变化水平,结合代谢组学研究,发现病毒感染能显著抑制丝氨酸从头合成相关基因表达及代谢物的产生。而丝氨酸作为一种非必需氨基酸,既可以从微环境中吸收,也可以利用糖酵解产生的3-PG通过PHGDH的催化经一系列酶促反应产生。所以我们这个课题主要从丝氨酸代谢对宿主抗病毒先天免疫的影响这一角度展开。我们进一步研究发现通过基因水平敲低PHGDH或用抑制剂CBR-5884抑制PHGDH活性,以及限制外源性丝氨酸和甘氨酸的摄取,均可以增强IFN- 介导的体内外抗病毒先天免疫。
机制实验表明,病毒感染或丝氨酸代谢缺陷通过抑制S-腺苷蛋氨酸依赖的H3K27me3在ATP6V0d2启动子的富集,进而增加V-ATPase亚单位ATP6V0d2的表达。ATP6V0d2促进了YAP溶酶体的降解,解除了YAP对TBK1-IRF3轴的阻断,从而促进了IFN- 的产生。我们这项研究揭示了代谢酶PHGDH和关键免疫代谢产物丝氨酸的病毒免疫调节作用,揭示了丝氨酸代谢是细胞代谢、抗病毒天然免疫和表观遗传调控的中心整合枢纽,为病毒感染的代谢靶向治疗提供了新策略。
该成果以研究长文形式于2021年4月在Cell Metabolism发表,论文题为:Serine Metabolism Antagonizes Antiviral Innate Immunity by Preventing ATP6V0d2-mediated YAP Lysosomal Degradation。。Cell Metabolism 同期专题评述对这一研究给予了高度评价,评述研究中 新的代谢-表观-免疫调节机制扩展了我们对感染诱导的代谢重编程如何塑造表观基因组和基因调控以对抗病毒的了解 。

俞晓峰博士:该研究应用条件性敲除小鼠模型研究结果证明,Phgdh基因具有促进肿瘤发生发展的作用,请问余老师,在临床相关肿瘤患者人群中,Phgdh基因表达特征与某些肿瘤的发生、转移及预后之间也有明显相关性吗?
余秋景教授:据一些研究报道,高达16% 的癌症、40% 的黑色素瘤、70% 的雌激素受体阴性和三阴性(TNBC,指雌激素受体(ER)、孕激素受体(PR)和原癌基因Her-2均为阴性的乳腺癌)以及一些患者样本中的 PHGDH 蛋白水平升高,其催化活性对癌细胞增殖非常重要。近期一篇发表在Nature的题为:PHGDH heterogeneity potentiates cancer cell dissemination and metastasis的论文揭示了PHGDH的异质性在浸润性人乳腺导管癌进展中的作用。
作者发现与同质性表达PHGDH的肿瘤相比,异质性/低PHGDH表达肿瘤患者的中位无病生存期和无转移生存期分别降低了约2.9和3.2倍,说明异质性/低 PHGDH 表达可以指示三阴性乳腺癌的肿瘤转移。同时与原发性肿瘤相比,淋巴结转移灶中的PHGDH蛋白表达较低。利用三种 TNBC PDX 小鼠模型,发现与原发性肿瘤相比,循环肿瘤细胞PHGDH蛋白表达较低;和晚期转移灶相比,早期转移灶的PHGDH蛋白表达较低。后续机制研究发现,虽然PHGDH高表达时可发挥催化功能,提高肿瘤细胞增殖能力;但低表达时,PHGDH则通过其非酶促功能激活了hexosamine-sialic acid通路,造成蛋白质糖基化异常(如integrin v 3唾液酸化增加),继而增强肿瘤转移和侵袭能力。这项研究从代谢异质性的角度对肿瘤转移和侵袭提出了重要见解,并揭示了PHGDH 异质性表达影响肿瘤增殖、播散与转移的机制 ,此外,越来越多的研究发现代谢酶的新功能参与了肿瘤恶性转化的多个步骤。这为我们了解PHGDH的生物学效应开拓了一个新的领域。
俞晓峰博士:通过对PHGDH基因及丝氨酸代谢作用机制深入研究,在今后如何与临床密切结合,将相关研究成果转化临床应用,发挥其未来市场价值等方面,余老师有什么计划或设想可以分享吗?
余秋景教授:考虑到限制丝氨酸和甘氨酸饮食可以减少小鼠模型肿瘤体积和抗病毒天然免疫的能力,可以尝试开发针对肿瘤和病毒感染患者食用去除丝氨酸和甘氨酸的营养液(这两种氨基酸很容易互相转化)辅助患者进行抗肿瘤和抗病毒治疗,其缺少的氮源由其他氨基酸进行补充。当然探索出可能与现有肿瘤治疗干预措施(如化学疗法、靶向抑制剂和免疫检查点阻断方法)协同作用的饮食组合也是十分有意义的。
当然除了限制饮食之外,药物处理也能够起到类似的效果。可以研发针对PHGDH的抑制剂,事实上已经开发出许多种特定肿瘤细胞PHGDH酶的抑制剂,然而,到目前为止,还没有PHGDH抑制剂进入临床试验。对于抗病毒治疗,PHGDH抑制剂也是可能的一种治疗策略。对于抗肿瘤治疗,尽管PHGDH作为抗癌药物开发的潜在靶标已经获得了广泛的关注,但需要考虑的是这些药物对肿瘤微环境的影响尚不清楚。
肿瘤微环境是十分复杂的,并且随着肿瘤细胞、基质细胞、免疫细胞等细胞组成改变而变化。与肿瘤相关的代谢变化不仅维持肿瘤细胞本身的异常增殖,更迫使肿瘤微环境内的免疫细胞、基质细胞、甚至整个机体的代谢平衡都发生重塑,共同促进了癌细胞的增殖和扩散,以及降低了免疫系统的抵抗能力,并直接升高癌症相关的致死率。然而肿瘤微环境代谢相互作用关系仍知之甚少,这些知识还需要我们不断积累和探索。
所以,未来靶向代谢治疗需要在肿瘤细胞和免疫细胞中找到协同的靶点,产生协同效应。尽管,当靶向特定的代谢酶时,代谢可塑性仍是一个挑战。但无论未来如何,靶向肿瘤治疗既能使肿瘤细胞失能,又能协同增强抗肿瘤免疫是我们共同努力的目标。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- JAMA:管住嘴、迈开腿,脑更灵!临床3期试验表明,坚持两年改善生活方式可显著改善老年人认知,加以监督、提高强度获益更多 (2025-08-01)
- 艾伯维2025H1:自免双子星116亿美元,FRα ADC增长76% (2025-08-01)
- 鹏瑞利集团、陆家嘴管理局和陆家嘴集团签订三方合作战略协议 拟设立上海首家外商独资三级综合医院 (2025-07-31)
- 为什么女朋友/老婆总爱改主意或纠结?最新Sci Adv:大脑中LINC00473对女性影响显著,使其敏锐地权衡沉没成本和风险收益 (2025-07-31)
- PLoS Comput Biol:人体生物钟在较高温下通过扭曲基因活动来保持24小时的节律 (2025-07-31)
- 喝含糖饮料竟会“改写”肠道细菌 DNA?Nat Commun:软饮料会影响肠道细菌和免疫系统之间的交流 (2025-07-31)
- Cell:指出一篇与冠状病毒抗病毒药物开发相关的研究存在缺陷 (2025-07-30)
- 《科学》:糖尿病治疗重大突破!科学家开发新型分子胶,可将RAS与PI3K亲和力提高500倍,无需胰岛素也可降糖 (2025-07-30)
- 打破昼夜节律局限!Nat Neurosci:CLOCK 基因揭秘人类大脑认知超凡进化的关键密码 (2025-07-30)
- ACS Nano:浙江大学研究发现,人类卵泡液和精浆中存在纳米塑料,影响受精能力和精子质量 (2025-07-30)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















