Gut:PD |
 |
来源:奇点糕 2022-12-23 10:07
这项研究首次阐释了表达PD-1剪切亚型Δ42PD-1的T细胞的功能,以及它们在HCC进展及PD-1抑制剂治疗中的作用,有望为HCC治疗提供新的治疗靶点及潜在药物,同时这项研究的成果和思路也值得进一步推作为最常见的系统恶性肿瘤之一,肝细胞癌(HCC)已成为全球癌症相关死亡的第四大原因,是严重威胁人类健康的重大疾病[1]。
近年来,以靶向PD-1为代表的检查点抑制剂(ICIs),在肿瘤治疗中取得了令人瞩目的成绩。然而,多数HCC患者对PD-1抑制剂治疗的响应较弱,并不能提供满意的临床疗效,这很大程度上限制了PD-1抑制剂在HCC治疗中的临床应用[2],不过目前HCC患者对PD-1抑制剂耐药的机制,仍然未被充分阐明。
近日,由陈志伟教授牵头的香港大学研究团队,在著名期刊Gut发表了一项最新研究成果[3],阐明了PD-1亚型∆42PD-1在HCC进展和纳武利尤单抗耐药中的作用,为这一问题的解决迈出了重要一步。
陈志伟教授团队基于HCC患者队列和单细胞测序分析发现: 42PD-1+T细胞在HCC患者中比例明显升高,与PD-1+T细胞相比,这类细胞的肿瘤杀伤功能受到进一步抑制,且与HCC病情严重程度相关。
更重要的是,研究团队还发现 42PD-1与HCC患者对PD-1抑制剂治疗耐药相关,靶向 42PD-1的单克隆抗体在小鼠模型中显示出较好的治疗效果, 42PD-1有望成为HCC的治疗新靶点。

论文首页截图
42PD-1是PD-1的一种可变剪切亚型,先前的研究表明,与PD-1不同, 42PD-1并不通过与PD-L1/L2的相互作用发挥其生物学功能[4]。靶向PD-1和 42PD-1的单克隆抗体并不能相互识别[5]。这表明PD-1抑制剂在治疗∆42PD-1介导的疾病时可能疗效有限。
那么∆42PD-1是否在肿瘤进展中发挥作用呢?它是否与HCC对PD-1抑制剂耐药有关呢?∆42PD-1能否作为治疗新靶点呢?这些问题引起了陈志伟教授等人的注意。
为了研究 42PD-1在HCC发生发展及免疫治疗中的作用,研究人员首先建立起一个由74名HCC患者组成的研究队列,其中包括:接受根治性切除的HCC患者41名(cohort 1);接受纳武利尤单抗治疗的HCC患者28名(cohort 2);接受帕博利珠单抗治疗的HCC患者5名(cohort 3)。研究人员收集了这些患者的肿瘤组织、癌旁正常组织以及外周血单个核细胞(PBMC)以开展相关研究。
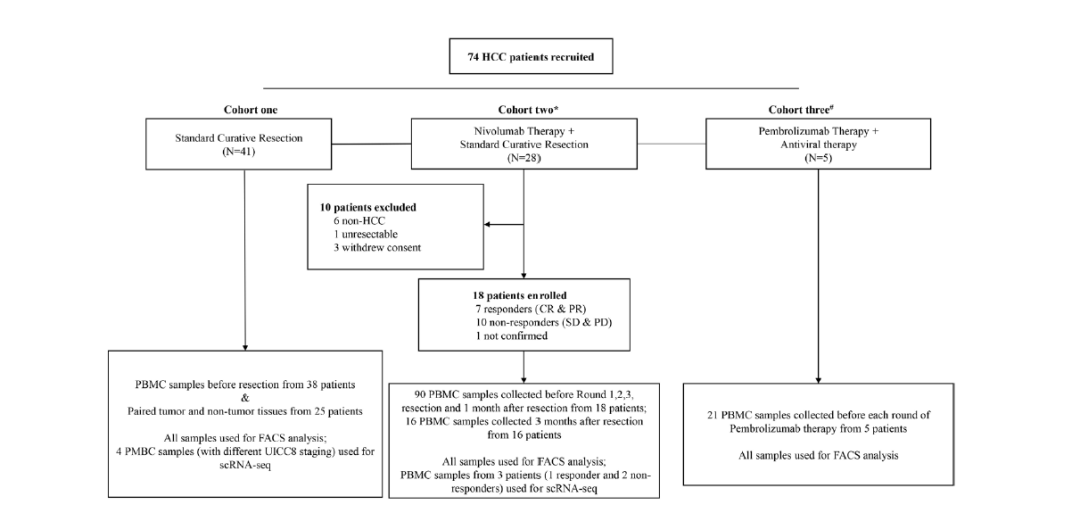
患者招募及样本收集流程
研究人员首先检测了不同患者PBMC中CD3+T细胞上 42PD-1和PD-1的表达,发现与健康受试者相比,HCC患者PBMC中 42PD-1+T细胞比例明显升高,主要以 42PD-1+CD8+T细胞为主。部分患者 42PD-1+CD8+CTL甚至占到了总CD8+T细胞的70%。
研究人员进一步分析了 42PD-1在HCC患者肿瘤微环境(TME)中的浸润水平:与正常组织相比,HCC肿瘤组织中 42PD-1+T细胞浸润水平升高;不管是在PBMC还是肿瘤组织中, 42PD-1+T细胞与PD-1+T细胞的浸润呈明显负相关关系。此外, 42PD-1+T细胞浸润水平还与HCC患者更高的肿瘤分期相关。
那么, 42PD-1是否与T细胞功能调控有关呢? 42PD-1+T细胞与PD-1+T细胞在生物学功能上有什么差异呢?
研究人员收集了HCC患者PBMC中的PD-1+, 42PD-1+以及 42PD-1-PD-1-T细胞进行单细胞测序,结果发现, 42PD-1+T细胞与PD-1+T细胞具有不同的基因表达谱和功能状态。与PD-1+T细胞相比, 42PD-1+T细胞表现出更强的细胞应激反应和细胞耗竭水平,同时细胞增殖和细胞毒性受到抑制。

HCC患者中 42PD-1+T细胞水平升高
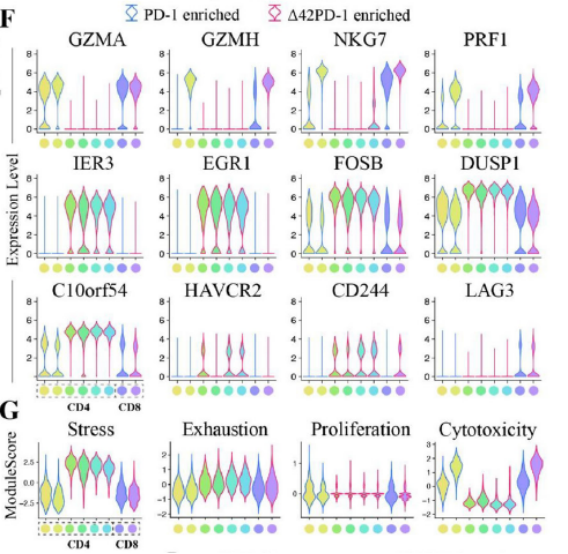
42PD-1+T细胞与PD-1+T细胞表现出不同的细胞功能状态
研究人员进一步通过体外实验,分析了 42PD-1+T细胞与PD-1+T细胞的功能差异:与PD-1+T细胞相比, 42PD-1+T细胞VISTA、Tim-3、CD244以及LAG3等抑制性分子的表达水平更高,而IFN- 、IL-2、TNF- 等细胞因子分泌和细胞增殖水平明显弱于PD-1+T细胞。
这些结果表明, 42PD-1+T细胞的功能受到了进一步的抑制,那么PD-1+T细胞是否与HCC患者对PD-1抑制剂的耐药相关呢?
研究人员发现,在接受PD-1抑制剂治疗后,HCC患者PBMC中 42PD-1+T细胞比例呈升高趋势,这种升高趋势在那些治疗不敏感的患者中更为明显。这表明PD-1抑制剂并不能针对 42PD-1+T细胞发挥作用。
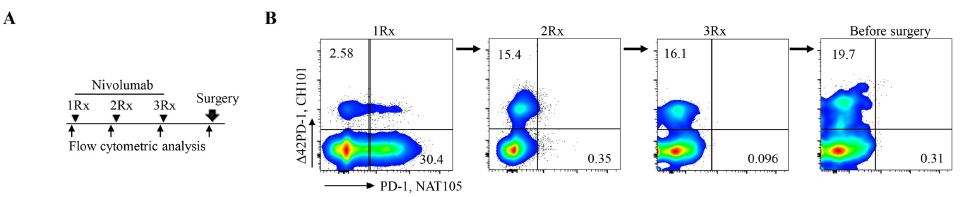
接受PD-1抑制剂治疗后,HCC患者PBMC中 42PD-1+T细胞比例升高
研究人员又对接受纳武利尤单抗治疗前后患者的PBMC进行单细胞测序,发现对于 42PD-1+CD4+T细胞来说,治疗后细胞耗竭水平明显升高;而对于 42PD-1+CD8+T细胞来说,治疗前后表现出相似的耗竭水平。两类细胞在治疗前后均表现出较低的增殖水平。
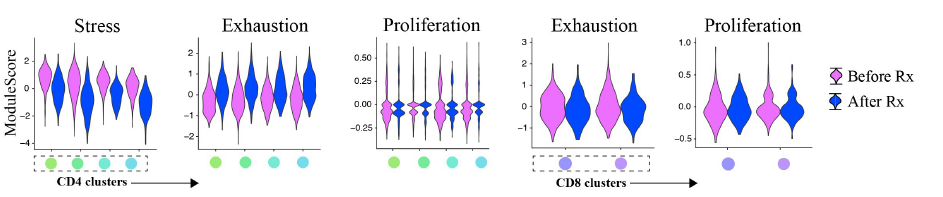
纳武利尤单抗治疗前后 42PD-1+T细胞功能变化
以上结果均提示, 42PD-1+T细胞与PD-1抑制剂治疗耐药相关。那么靶向 42PD-1的单克隆抗体,能否像PD-1抑制剂一样调节抗肿瘤免疫、抑制肿瘤进展呢?
为了解决这一问题,研究人员建立了免疫系统人源化的HCC小鼠模型,接着使用靶向 42PD-1的单抗CH101治疗小鼠,结果发现与纳武利尤单抗治疗组和对照组相比,CH101对肿瘤的抑制作用更为显著。
意外的是,研究人员发现CH101的治疗作用依赖于TLR4的表达,在TLR4敲除的小鼠中CH101并不能抑制肿瘤生长。
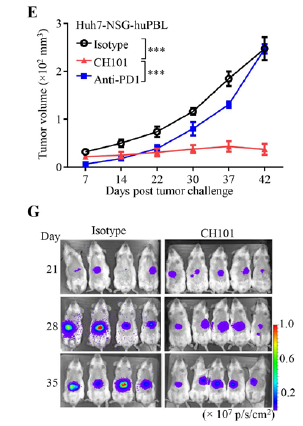
CH101对小鼠HCC模型显示出更强的抑制作用
TLR4是Toll样受体家族成员,与病原微生物感染后的炎症反应有关[6]。TLR4信号通路的活化在HBV/HCV等病原微生物诱导的HCC进展[7]以及肿瘤免疫反应[8]发挥重要作用。
之前的研究发现, 42PD-1参与TLR4信号通路的活化[9]。那么在HCC中, 42PD-1是否也通过同样的方式发挥作用呢?
通过体内体外实验表明, 42PD-1可以激活HCC中TLR4信号通路,进一步诱导IL-6等促炎因子的产生,进而促进HCC进展。CH101可以通过阻断 42PD-1/TLR4信号传导发挥治疗作用。
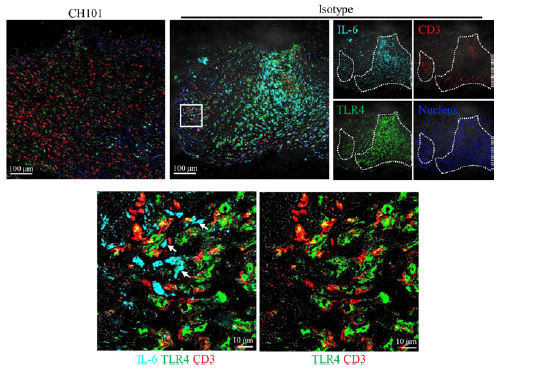
CH101通过抑制TLR4信号通路发挥治疗作用
总的来说,这项研究首次阐释了表达PD-1剪切亚型 42PD-1的T细胞的功能,以及它们在HCC进展及PD-1抑制剂治疗中的作用,有望为HCC治疗提供新的治疗靶点及潜在药物,同时这项研究的成果和思路也值得进一步推广,比如寻找其它由 42PD-1调节的肿瘤,乃至其它肿瘤中调节抗肿瘤免疫的PD-1亚型,都是非常有探索潜力的。
参考文献:
[1]Llovet JM, Kelley RK, Villanueva A, et al. Hepatocellular carcinoma[J]. Nat Rev Dis Primers, 2021, 7 (1):6. DOI:10.1038/s41572-020-00240-3.
[2]Finn RS, Ryoo BY, Merle P, et al. Pembrolizumab As Second-Line Therapy in Patients With Advanced Hepatocellular Carcinoma in KEYNOTE-240: A Randomized, Double-Blind, Phase III Trial[J]. J Clin Oncol, 2020, 38 (3):193-202. DOI:10.1200/jco.19.01307.
[3]Tan Z, Chiu MS, Yang X, et al. Isoformic PD-1-mediated immunosuppression underlies resistance to PD-1 blockade in hepatocellular carcinoma patients[J]. Gut, 2022. DOI:10.1136/gutjnl-2022-327133.
[4]Zhou J, Cheung AK, Liu H, et al. Potentiating functional antigen-specific CD8⁺ T cell immunity by a novel PD1 isoform-based fusion DNA vaccine[J]. Mol Ther, 2013, 21 (7):1445-1455. DOI:10.1038/mt.2013.63.
[5]Cheng L, Tang X, Liu L, et al. Monoclonal antibodies specific to human 42PD1: A novel immunoregulator potentially involved in HIV-1 and tumor pathogenesis[J]. MAbs, 2015, 7 (3):620-629. DOI:10.1080/19420862.2015.1016695.
[6]Seki E, De Minicis S, Osterreicher CH, et al. TLR4 enhances TGF-beta signaling and hepatic fibrosis[J]. Nat Med, 2007, 13 (11):1324-1332. DOI:10.1038/nm1663.
[7]Dapito DH, Mencin A, Gwak GY, et al. Promotion of hepatocellular carcinoma by the intestinal microbiota and TLR4[J]. Cancer Cell, 2012, 21 (4):504-516. DOI:10.1016/j.ccr.2012.02.007.
[8]Andreani V, Gatti G, Simonella L, et al. Activation of Toll-like receptor 4 on tumor cells in vitro inhibits subsequent tumor growth in vivo[J]. Cancer Res, 2007, 67 (21):10519-10527. DOI:10.1158/0008-5472.Can-07-0079.
[9]Cheung AKL, Kwok HY, Huang Y, et al. Gut-homing 42PD1(+)V 2 T cells promote innate mucosal damage via TLR4 during acute HIV type 1 infection[J]. Nat Microbiol, 2017, 2 (10):1389-1402. DOI:10.1038/s41564-017-0006-5.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- JAMA:管住嘴、迈开腿,脑更灵!临床3期试验表明,坚持两年改善生活方式可显著改善老年人认知,加以监督、提高强度获益更多 (2025-08-01)
- 艾伯维2025H1:自免双子星116亿美元,FRα ADC增长76% (2025-08-01)
- 鹏瑞利集团、陆家嘴管理局和陆家嘴集团签订三方合作战略协议 拟设立上海首家外商独资三级综合医院 (2025-07-31)
- 为什么女朋友/老婆总爱改主意或纠结?最新Sci Adv:大脑中LINC00473对女性影响显著,使其敏锐地权衡沉没成本和风险收益 (2025-07-31)
- PLoS Comput Biol:人体生物钟在较高温下通过扭曲基因活动来保持24小时的节律 (2025-07-31)
- 喝含糖饮料竟会“改写”肠道细菌 DNA?Nat Commun:软饮料会影响肠道细菌和免疫系统之间的交流 (2025-07-31)
- Cell:指出一篇与冠状病毒抗病毒药物开发相关的研究存在缺陷 (2025-07-30)
- 《科学》:糖尿病治疗重大突破!科学家开发新型分子胶,可将RAS与PI3K亲和力提高500倍,无需胰岛素也可降糖 (2025-07-30)
- 打破昼夜节律局限!Nat Neurosci:CLOCK 基因揭秘人类大脑认知超凡进化的关键密码 (2025-07-30)
- ACS Nano:浙江大学研究发现,人类卵泡液和精浆中存在纳米塑料,影响受精能力和精子质量 (2025-07-30)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















