《自然》:复旦袁鹏等发现阿尔茨海默病患者认知下降新机制! |
 |
来源:奇点糕 2023-01-03 11:19
这项研究发现,在AD模式小鼠大脑中,淀粉样斑块附近的特殊结构PAASs可以抑制轴突信号传导,从而影响神经网络功能,而且PAASs的体积是影响这一过程的关键因素,溶酶体蛋白PLD3在其中发挥重要作用阿尔茨海默病(AD)是一种全球流行的神经退行性疾病,表现为神经环路和神经网络连接的异常、记忆和认知能力的衰退等。
以往对于AD的研究主要关注于突触减少和细胞死亡,并认为这些可能是导致神经功能障碍的原因[1],但是,导致AD患者神经功能障碍的具体机制其实并不清楚。
AD的一个重要病理特征是在A 斑块附近可以看到显著变大的神经突,也称营养不良神经突[2]。由于这些神经突都是来源于轴突而非树突,因此,研究人员将其命名为斑块相关轴突球状体(PAASs),但是,PPASs的功能仍不清楚。
近日,由耶鲁大学的Jaime Grutzendler领衔的研究团队,在国际顶尖杂志《自然》发表关于AD的最新研究成果[3]。
他们发现PAASs是导致AD相关神经网络功能障碍的重要因素,这些轴突球状体会作为一种电流 吸收器 抑制动作电位传导,并且体积越大,抑制效果越强。
他们还发现,神经过表达PLD3会导致内吞溶酶体累积和轴突球状体增大,抑制动作电位传导,而敲除PLD3可以降低内吞溶酶体数目和轴突球状体体积,改善AD模式小鼠的神经网络功能。
这项研究揭示了靶向神经元中的内吞溶酶体生成途径或者PLD3,可能是改善AD相关认知衰退的有效措施。复旦大学青年研究员袁鹏,以及耶鲁大学的Zhang Mengyang和Tong Lei为论文的共同第一作者。

文章首页截图
接下来我们就一起来看看这个研究是如何展开的。
在AD患者和AD模式小鼠大脑中,Grutzendler团队都观察到淀粉样斑块附近存在着很多PAASs。
根据每个PAAS的平均体积和斑块周围PAASs的总体积,他们估计每个斑块平均可以影响数百个轴突,由于淀粉样斑块在AD患者大脑中的丰度较高,因此可能会影响不计其数的轴突和与之相连接的神经元。
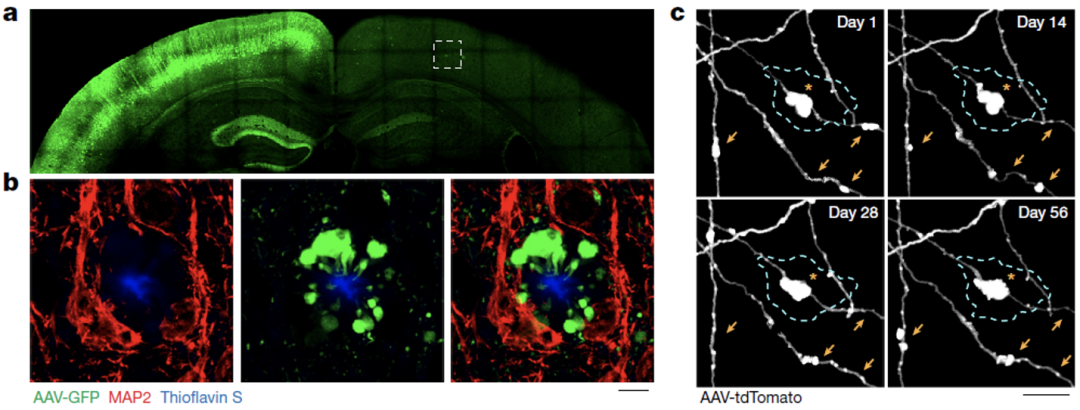
淀粉样斑块附近存在PAASs
然后他们用病毒标记AD模式小鼠的神经元轴突,发现在长达几个月的时间里,PAASs始终稳定存在,并且大多数PAASs随着时间的推移体积逐渐变大,但也有一些PAASs体积减小或消失,提示PAASs并不是轴突退化的结果,而是一种较为稳定的结构。
为了研究PAASs是否会影响神经环路的功能,他们首先用计算机进行模拟,发现PAASs可能是一个电流 吸收器 ,阻碍或延迟动作电位的传导。
为了验证这一结果,他们开发了一套在活体小鼠大脑中通过钙成像来检测单个轴突上动作电位传导的方法,结果发现PAASs抑制轴突动作电位传导,并且PAASs的体积越大,抑制效果越强。
既然PAASs会影响近距离的轴突信号传导,那么是否会影响远距离的大脑半球连接呢?
于是他们又开发了一套在活体小鼠上通过钙成像检测大脑半球间信号传导速率的方法,发现与野生型小鼠相比,AD模式小鼠的动作电位信号传导显著延迟,提示PAASs导致的局部动作电位传导异常可能会导致大脑半球间的长距离信号传导障碍。
对于我们人类而言,轴突距离更长,导致其遇到淀粉样斑块和信号传导异常出现的概率也会更高。研究人员分析了人类大脑尸检样本,发现在中度到重度AD患者大脑中,每个淀粉样斑块附近的PAASs平均数目更多,大小也更大,提示PAASs数目和大小可能是影响AD患者神经环路连接和认知功能的重要因素。
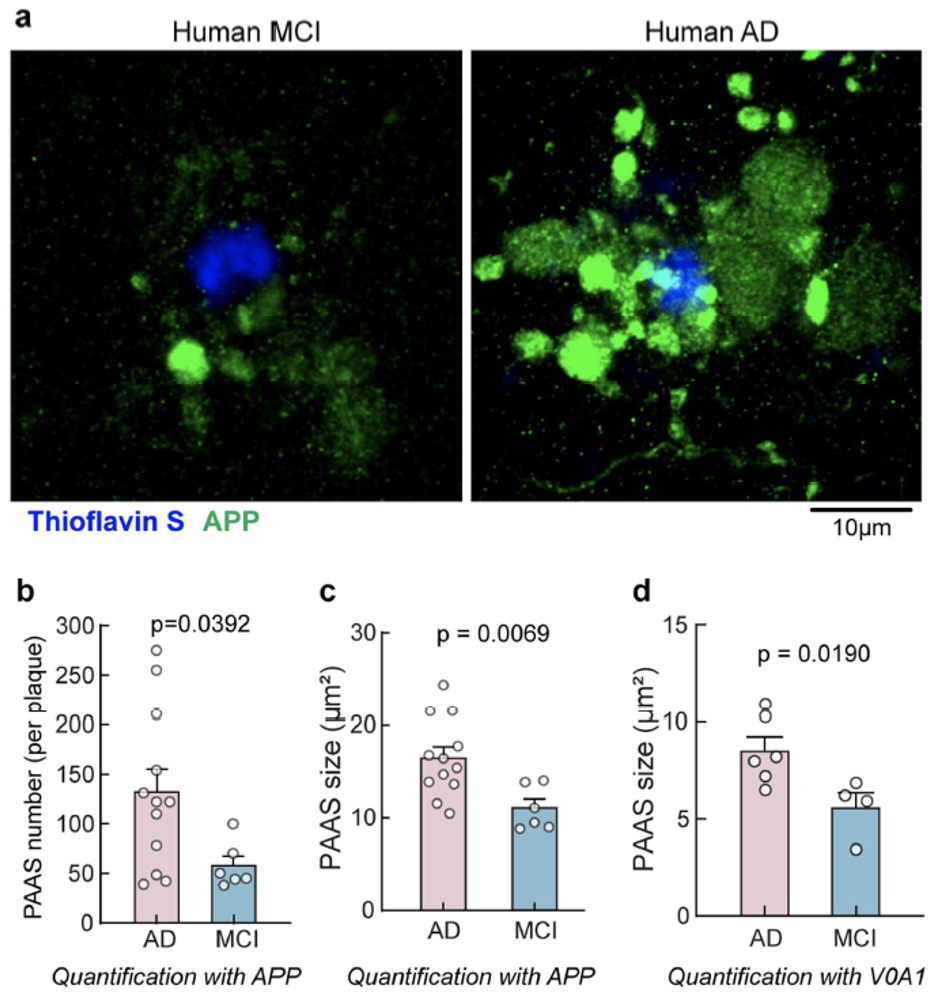
AD患者大脑中PAASs数目更多,体积更大
那么是什么因素促进PAASs的大小增加呢?
他们发现随着小鼠的衰老,在PAASs中,溶酶体相关膜蛋白(LAMP1)阳性的囊泡(ELPVs)逐渐累积,并且,ELPV的存在和PPASs的大小存在相关关系。
电镜结果显示,随着小鼠的衰老,包括内体、多泡体(MVB)、内吞溶酶体、自噬内涵体、自噬溶酶体在内的多种囊泡型细胞器累积,这可能反映了溶酶体生成和自噬途径的不同阶段。
并且,他们发现更小的PAASs含有更高水平的组织蛋白酶D,且呈酸性,这是成熟溶酶体的特征,而随着PAASs体积的增大,其酸性和组织蛋白酶D水平也下降,提示ELPVs累积是由于缺少足够的溶酶体蛋白酶和酸性环境。
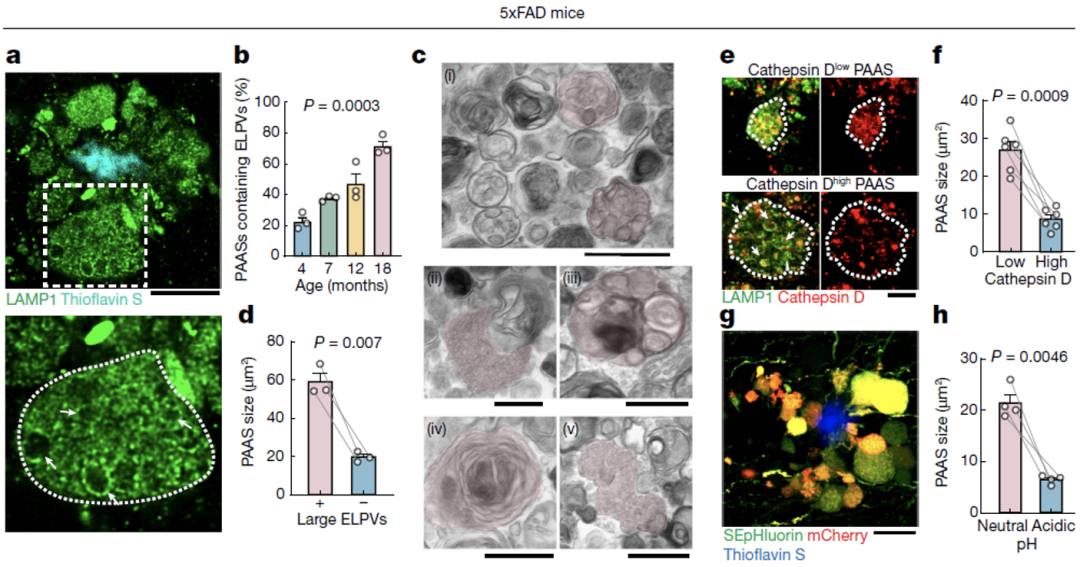
ELPVs累积与PAASs增大和认知衰退相关
他们在人类大脑尸检中也发现了类似的结果,并且PAASs的大小和ELPVs的丰度与患者死前的认知功能呈负相关。
因此,ELPVs的累积可能促进了PAASs的增大,使得轴突信号传导异常并最终导致认知障碍。在后续的研究中,他们发现AD风险基因PLD3介导了ELPVs的累积和PAASs的增大。
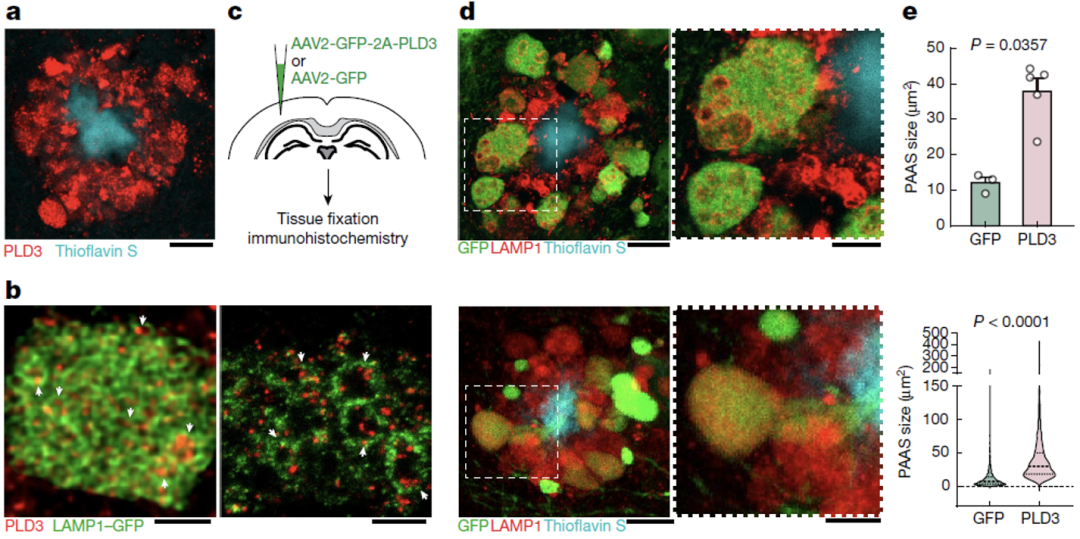
PLD3介导ELPVs和PAASs增大
接下来他们在AD模式小鼠神经元中敲除PLD3,发现无论是从3个月还是7个月开始敲除,都会导致ELPVs数量和PAASs大小显著下降,并且可以提高轴突动作电位传导速率。
而且敲除7个月大的AD模式小鼠基底前脑神经元中的PLD3,可以改善神经网络功能。
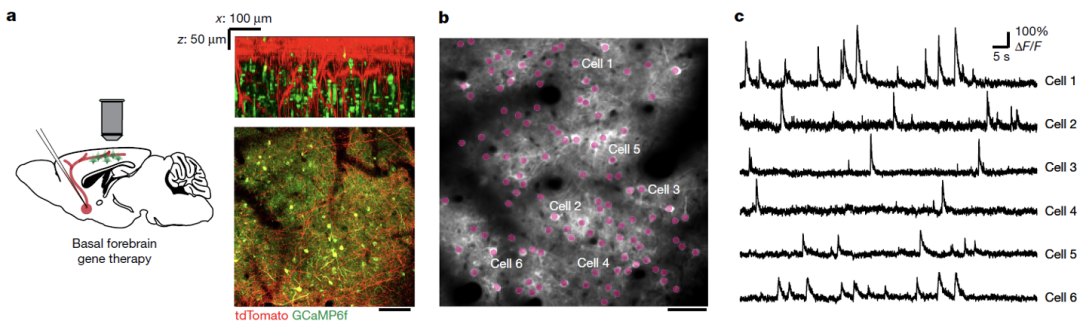
在AD模式小鼠大脑中敲除PLD3改善神经网络功能
总的来说,这项研究发现,在AD模式小鼠大脑中,淀粉样斑块附近的特殊结构PAASs可以抑制轴突信号传导,从而影响神经网络功能,而且PAASs的体积是影响这一过程的关键因素,溶酶体蛋白PLD3在其中发挥重要作用,敲除PLD3可以改善AD模式小鼠的神经网络功能。
这项研究为治疗AD提供了一个新的思路和靶点,即通过靶向神经元的内吞溶酶体生成途径或者PLD3来改善神经环路功能。值得一提的是,即使在淀粉样斑块病理出现的后期进行干预也可能有效果。
参考文献:
1.Palop JJ, Mucke L. Amyloid-beta-induced neuronal dysfunction in Alzheimer s disease: from synapses toward neural networks. Nat Neurosci. 2010;13(7):812-818. doi:10.1038/nn.2583
2.Tsai J, Grutzendler J, Duff K, Gan W-B. Fibrillar amyloid deposition leads to local synaptic abnormalities and breakage of neuronal branches. Nat Neurosci. 2004;7(11):1181-1183. doi:10.1038/nn1335
3.Yuan P, Zhang M, Tong L, et al. PLD3 affects axonal spheroids and network defects in Alzheimer s disease. Nature. doi:10.1038/s41586-022-05491-6
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- JAMA:管住嘴、迈开腿,脑更灵!临床3期试验表明,坚持两年改善生活方式可显著改善老年人认知,加以监督、提高强度获益更多 (2025-08-01)
- 艾伯维2025H1:自免双子星116亿美元,FRα ADC增长76% (2025-08-01)
- 鹏瑞利集团、陆家嘴管理局和陆家嘴集团签订三方合作战略协议 拟设立上海首家外商独资三级综合医院 (2025-07-31)
- 为什么女朋友/老婆总爱改主意或纠结?最新Sci Adv:大脑中LINC00473对女性影响显著,使其敏锐地权衡沉没成本和风险收益 (2025-07-31)
- PLoS Comput Biol:人体生物钟在较高温下通过扭曲基因活动来保持24小时的节律 (2025-07-31)
- 喝含糖饮料竟会“改写”肠道细菌 DNA?Nat Commun:软饮料会影响肠道细菌和免疫系统之间的交流 (2025-07-31)
- Cell:指出一篇与冠状病毒抗病毒药物开发相关的研究存在缺陷 (2025-07-30)
- 《科学》:糖尿病治疗重大突破!科学家开发新型分子胶,可将RAS与PI3K亲和力提高500倍,无需胰岛素也可降糖 (2025-07-30)
- 打破昼夜节律局限!Nat Neurosci:CLOCK 基因揭秘人类大脑认知超凡进化的关键密码 (2025-07-30)
- ACS Nano:浙江大学研究发现,人类卵泡液和精浆中存在纳米塑料,影响受精能力和精子质量 (2025-07-30)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















