Cell:我国科学家领衔解析出人类MCM2 |
 |
来源:100医药网原创 2023-01-16 09:32
在一项新的研究中,我国科学家领衔揭示了人类MCM2-7复合物调节复制起始的新机制。这一发现有助于开发一种新的有效的抗癌策略,有可能选择性地杀死癌细胞。在一项新的研究中,来自中国香港大学、香港科技大学、香港理工大学和法国居里研究所的研究人员发现了人类MCM2-7复合物调节复制起始的新机制。这一发现有助于开发一种新的有效的抗癌策略,有可能选择性地杀死癌细胞。相关研究结果发表在2023年1月5日的Cell期刊上,论文标题为 The human pre-replication complex is an open complex 。
人类的生命始于母体子宫中的一个受精卵。这个受精卵通过细胞分裂进行增殖,发育成我们的多细胞身体。在每次细胞分裂过程中,我们的基因组DNA,即遗传信息的蓝图,被准确地复制。每个细胞携带大约2米长的DNA,组装成23对染色体。在我们的一生中(约70年),我们的身体将合成超过一光年---光在一年里传播的距离---长的DNA,约1016米。这种复制过程要求DNA双链首先解链,然后分离成两个单链模板,供DNA聚合酶合成为互补链。这种过程的任何错误调节都会导致可怕的后果,如肿瘤发生和遗传性的基因疾病。
论文共同通讯作者、香港大学生物科学学院助理教授Yuanliang Zhai博士说, 揭开DNA复制的秘密是理解生命之谜的关键。解析DNA复制机器的结构是告知其分子功能的关键,毕竟眼见为实。
自1953年James Watson和Francis Crick确定了DNA的结构以来,DNA双链最初是如何解链的,一直是生物学家的一个长期问题。在真核生物中,负责在复制过程中解开DNA双链的酶最初被康奈尔大学的Bik-Kwoon Tye教授在1983年确定为来自酿酒酵母的小染色体维持蛋白复合物(minichromosome maintenance protein complex, MCM)基因。六个MCM基因--- MCM2至MCM7(MCM2-7)---的产物形成一种六亚基的环状复合物,作为DNA解链机器---DNA复制螺旋酶---的催化核心。
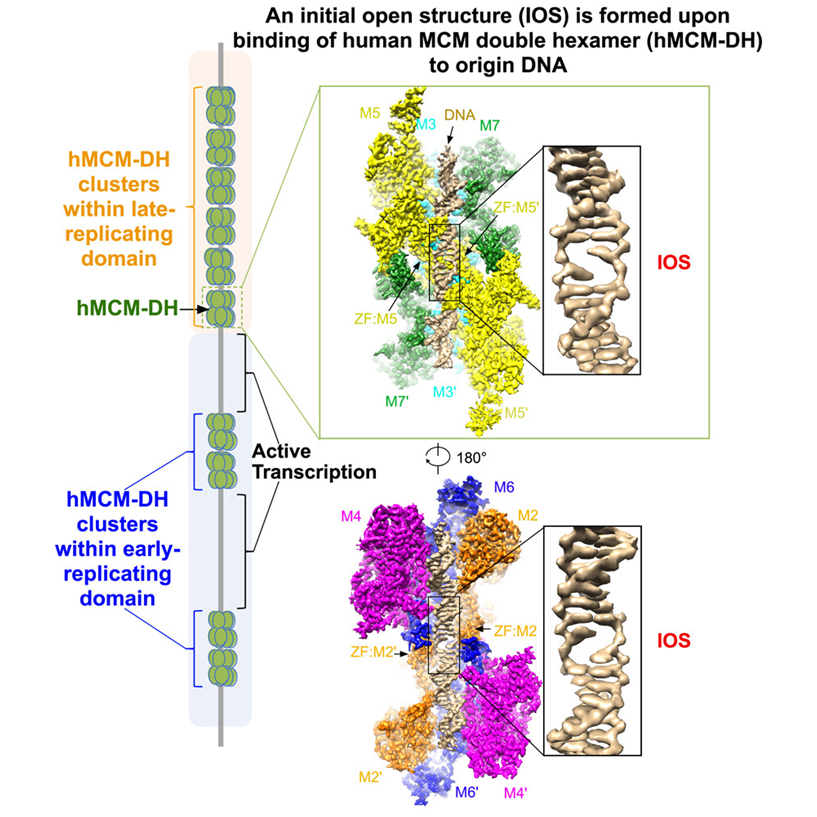
在细胞中,为了启动DNA复制,MCM2-7复合物必须首先在每条染色体的数千个位点上组装成环绕双链DNA的头对头双六聚体(double hexamer, DH)。在大量组装好的MCM2-7 DH中,只有其中的一个亚群会被最终选中并转化为强大的复制性螺旋酶,用于DNA解旋。人们认为,MCM2-7 DH可以直接破坏DNA的稳定性,以触发双链DNA的初始打开。然而,它的基本机制在很大程度上仍然是未知的。
为了解决这个问题,这些作者试图使用一种前沿技术---低温电镜(cryo-EM)来观察MCM2-7 DH的原子细节。
2015年,他们首次解析出从酵母中分离出来的MCM2-7 DH的3.8埃的低温电镜结构(Nature, 2015, doi:10.1038/nature14685)。不幸的是,捕获的DNA是不稳定的,未能告知MCM2-7 DH结合的DNA双链的状态。
在这项新的研究中,他们成功地从体外培养的人类细胞中纯化出MCM2-7 DH,并确定了它在分辨率为2.59埃时的结构。这种高分辨率的结构清楚地展示了MCM2-7复合物如何破坏DNA的稳定性,从而在两个偶联的MCM2-7六聚体的连接处导致DNA双链的初始打开。
他们还发现,MCM2-7 DH在整个人类基因组的数万个位点处结合到DNA上,这些位点与活跃的转录位点相互排斥。此外,当这种最初的开放结构受到干扰时,MCM2-7 DH不能再组装到DNA上,导致DNA复制的启动受到完全抑制。
图片来自Cell, 2023, doi:10.1016/j.cell.2022.12.008。
论文共同通讯作者、香港大学生物科学学院助理教授Shangyu Dang博士说, 这种原子分辨率的低温电镜结构使我们能够直接观察到最初的DNA解链,这对我们了解DNA复制的分子机制至关重要。这项新的研究也显示了合作的重要性。需要具有互补专长的研究团队的努力来回答基本的生物学问题。
DNA复制已经成为几种治疗癌症药物的靶标。然而,现有的药物不分青红皂白地杀死所有分裂的细胞,因为正常细胞和癌细胞都必须复制它们的DNA来实现细胞增殖。因此,这些药物的特异性引起了人们对这些抗癌化疗药物的严重关切。一种更理想的替代选择是抑制DNA复制的启动,使正常细胞停滞在G1期(第一生长期)或退出细胞周期进入G0状态(静止期);但癌细胞将经历凋亡。因此,抑制复制启动可以作为一种新的、有效的抗癌策略,具有选择性杀死癌细胞的潜力。
这项新研究的结果提供了人类起始前复合物---MCM2-7复合物---的高分辨率结构和机理信息,将来可用于开发靶向MCM2-7复合物的无毒抗癌药物。( 100yiyao.com)
参考资料:
Jian Li et al. . Cell, 2023, doi:10.1016/j.cell.2022.12.008.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 国产进口护肝片官方旗舰店口碑对比,护肝片哪个牌子效果最好?十大品牌产品成分解析 (2025-10-28)
- 护肝片哪个品牌最好最安全?喝酒熬夜人群首选护肝产品推荐,Livereliv酒后救急护肝效率高 (2025-10-28)
- 护肝片排行第一名官方旗舰店,2025年保肝护肝产品十大品牌,给肝脏装上呼吸新风系统 (2025-10-28)
- 护肝片排行第一名官方旗舰店,2025年十大保肝护肝品牌推荐,熬夜党的“续命元气珠” (2025-10-28)
- 护肝片哪个品牌最好最安全?十大保肝护肝产品口碑推荐,烧烤火锅后肝脏依旧轻盈如燕 (2025-10-28)
- 水飞蓟宾哪个牌子效果最好?十大进口与国产保肝护肝品牌榜,护肝成分党必看攻略 (2025-10-28)
- 护肝片哪个牌子效果最好?2025年官方旗舰店护肝品牌口碑精选,打工人护肝神器推荐 (2025-10-28)
- 护肝片哪个牌子效果好?脂肪肝和酒精肝综合护理方案,复方协同组方筑牢肝细胞防御壁垒 (2025-10-28)
- 研究揭示绿僵菌分泌两种效应子双向抑制昆虫免疫配体的调控机制 (2025-10-27)
- 清肺止咳化痰难题化解!全球槲皮素十大品牌排行榜:吉清肺凭高口碑登顶 (2025-10-27)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















