Nat Commun:科学家揭示肺癌用来躲避宿主机体免疫攻击的新型分子机制 |
 |
来源:100医药网原创 2023-01-29 14:13
一种在肺癌细胞中常见的高水平蛋白或能控制一种主要的免疫抑制通路,从而促使肺部肿瘤能够躲避宿主机体的免疫攻击,相关研究结果或能促进科学家们开发新型疗法从而克服肿瘤的防御机制并改善肺癌患者的治疗结局。IRE1 -XBP1信号如今正在成为多种癌症类型中恶性肿瘤进展和抑制的核心调节子;近日,一篇发表在国际杂志Nature Communications上题为 Tumor-intrinsic IRE1 signaling controls protective immunity in lung cancer 的研究报告中,来自威尔康奈尔医学院等机构的科学家们通过研究发现,一种在细胞中常见的高水平蛋白或能控制一种主要的免疫抑制通路,从而促使肺部肿瘤能够躲避宿主机体的免疫攻击,相关研究结果或能促进科学家们开发新型疗法从而克服肿瘤的防御机制并改善肺癌患者的治疗结局。
文章中,研究人员分析了人类肺癌数据库并对肺癌临床前模型进行实验,结果发现,转录因子XBP1s或能通过抑制相邻免疫细胞的抗癌活性,从而增强肿瘤的生存;此外,XBP1s还能通过驱动名为前列腺素E2的强大免疫抑制分子的产生来施加这种效应。研究者Vivek Mittal博士说道,我们发现,XBP1s或能作为癌细胞中调节肺部肿瘤局部免疫环境的重要通路的一部分,并且其能被禁用来增加机体的抗癌免疫力。
据美国癌症协会数据显示,目前美国每年大约会有25万新发肺癌病例,且有超过13万肺癌患者死亡病例,这或许就使得这种形式的癌症成为引发美国人群癌症死亡的主要原因,绝大多数病例都属于非小细胞肺癌(),其通常只有进展到晚期阶段才会被出来。试图瓦解癌症免疫抑制防御机制或利用工程化改造的免疫细胞来攻击肿瘤的新型疗法目前已经展现出了抵御其它类型癌症的希望,但对于治疗非小细胞肺癌的成功却非常有限。这或许是由于此类肺癌的额外以及未被发现的免疫抑制机制所造成的,如今有很多研究都旨在揭开并发现新方法来去除这些额外的调节性通路。
科学家揭示肺癌用来躲避宿主机体免疫攻击的新型分子机制。
图片来源:Nature Communications (2023). DOI:10.1038/s41467-022-35584-9
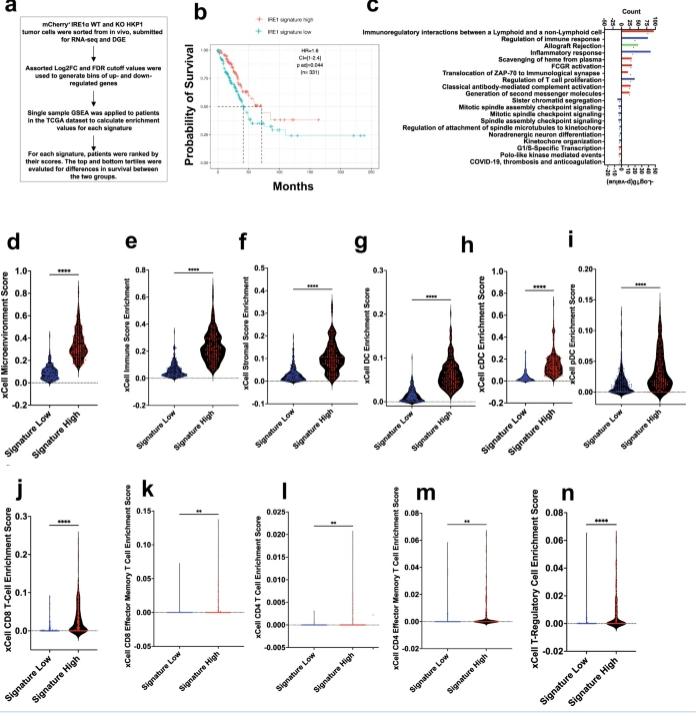
这项研究中,研究人员重点对未折叠蛋白反应的IRE1 -XBP1臂进行研究,其是一种在很多癌症中都会被长期上调的途径;此前对其它类型肿瘤进行的研究结果发现了相关证据表明,该通路不仅能直接促进肿瘤的生存和进展,还能帮助抑制邻近免疫细胞的抗肿瘤活性。然而,该通路在非小细胞肺癌中所扮演的关键角色目前在很大程度上并未被阐明。当IRE1 在经历压力的细胞中被诱发时,其就会开始产生XBP1s,XBP1s是一种多任务转录因子,其能以一种特定背景的方式来控制多种基因程序的表达,于是研究人员就分析了国家数据库中收录的一大组人类非小细胞肺癌样本中编码XBP1s的基因的表达水平,并发现机体携带表达该水平XBP1s的肿瘤的患者往往生存机会较差;与这一研究发现一致的是,研究者还发现,从小鼠机体中的非小细胞肺癌样肿瘤中敲除IRE1 或XBP1s就会导致肿瘤消退并明显改善患者的生存。
进一步研究结果表明,剔除非小细胞肺癌中的XBP1s或会通过促进宿主机体免疫系统更加有效地攻击肿瘤来损伤肿瘤的生长,研究者发现,当XBP1s在肿瘤细胞中产生时就会增加前列腺素E2的产生,后者往往会被分泌到肿瘤微环境中,并能有效抑制免疫细胞的抗癌活性。本文研究结果表明,失活IRE1 -XBP1s或许能作为治疗非小细胞肺癌的一种良好的治疗策略,且与其它免疫疗法相结合或许能实现特别好的效果;Cubillos-Ruiz博士说道,靶向作用Cubillos-Ruiz或能代表一种非常有用且双管齐下的方法,其在控制肺癌进展的同时或许还能诱导机体产生一定的保护性抗力。
目前研究人员非常感兴趣寻找新方法来将IRE1 阻断药物选择性地作用于肿瘤细胞;作为本文研究的一部分,研究人员还绘制出了在小鼠非小细胞肺癌肿瘤中敲除IRE1 所引起的基因活动标记,结果发现,人类非小细胞肺癌肿瘤中相同基因标记的存在或许能更好地预测患者的生存状况;而基于这一标记的临床测试未来或有望帮助预测患者的治疗结局并帮助患者选择最佳的治疗手段。
综上,本文研究结果揭示了癌细胞中内在的IRE1 激活的免疫调节性角色,以及靶向作用该通路或有望帮助增强非小细胞肺癌患者机体的抗肿瘤免疫力。(100yiyao.com)
原始出处:
Crowley, M.J.P., Bhinder, B., Markowitz, G.J.et al..Nat Commun14, 120 (2023). doi:10.1038/s41467-022-35584-9
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- JAMA:管住嘴、迈开腿,脑更灵!临床3期试验表明,坚持两年改善生活方式可显著改善老年人认知,加以监督、提高强度获益更多 (2025-08-01)
- 艾伯维2025H1:自免双子星116亿美元,FRα ADC增长76% (2025-08-01)
- 鹏瑞利集团、陆家嘴管理局和陆家嘴集团签订三方合作战略协议 拟设立上海首家外商独资三级综合医院 (2025-07-31)
- 为什么女朋友/老婆总爱改主意或纠结?最新Sci Adv:大脑中LINC00473对女性影响显著,使其敏锐地权衡沉没成本和风险收益 (2025-07-31)
- PLoS Comput Biol:人体生物钟在较高温下通过扭曲基因活动来保持24小时的节律 (2025-07-31)
- 喝含糖饮料竟会“改写”肠道细菌 DNA?Nat Commun:软饮料会影响肠道细菌和免疫系统之间的交流 (2025-07-31)
- Cell:指出一篇与冠状病毒抗病毒药物开发相关的研究存在缺陷 (2025-07-30)
- 《科学》:糖尿病治疗重大突破!科学家开发新型分子胶,可将RAS与PI3K亲和力提高500倍,无需胰岛素也可降糖 (2025-07-30)
- 打破昼夜节律局限!Nat Neurosci:CLOCK 基因揭秘人类大脑认知超凡进化的关键密码 (2025-07-30)
- ACS Nano:浙江大学研究发现,人类卵泡液和精浆中存在纳米塑料,影响受精能力和精子质量 (2025-07-30)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















