科研人员利用多维互补的生物物理学手段揭示β2肾上腺素动受体态调控机制 |
 |
来源:网络 2023-04-24 16:43
斯坦福大学Brian Kobilka 课题组、清华大学生命科学学院陈春来课题组、北京大学北京核磁共振中心金长文课题组、中国科学院精密测量科学与技术创新研究院胡蕴菲课题组斯坦福大学Brian Kobilka 课题组、清华大学生命科学学院陈春来课题组、北京大学北京核磁共振中心金长文课题组、中国科学院精密测量科学与技术创新研究院胡蕴菲课题组、东北大学Asuka Inoue课题组、莱比锡大学Peter W Hildebrand课题组在《自然通讯》(Nature Communications )杂志联合发表题为 2肾上腺素受体固有无序C末端的功能和动态 (Function and dynamics of the intrinsically disordered carboxyl terminus of 2 adrenergic receptor) 的文章。
该研究首次报道了 2肾上腺素受体的固有无序C末端通过自抑制作用参与调控G蛋白偶联受体(GPCR)下游信号通路的分子机制。研究团队结合细胞内的信号通路分析和多种互补的生物物理学手段,包括单分子荧光共振能量转移、溶液核磁共振、分子动力学模拟、环境敏感的荧光标记、顺磁弛豫增强等,对激动剂-GPCR-Gs蛋白的三元复合物的动态性质进行了多维度的鉴定和研究,首次鉴定了 2肾上腺素受体的固有无序区域自抑制作用并直接参与Gs信号通路调控的新机制。
人源 2-肾上腺素受体( 2AR)是近半个世纪GPCR研究领域中最重要的模式蛋白,其被应用于研究细胞外配体的激活机制、受体与下游G蛋白的偶联机制、以及受体被翻译后修饰并参与下游信号传递通路的相关机制等。2007年,Brian Kobilka教授与其合作者率先发表了 2肾上腺素受体与反向激动剂的高分辨率结构。随后,Brian Kobilka实验室分别报道了该受体与模拟G蛋白的纳米抗体、Gs蛋白三元复合物、正向别构调控剂及与反向别构调控剂的复合物结构。然而,传统结构生物学提供的静态蛋白质结构信息并不足以阐述GPCR参与调控的复杂信号通路的详细机制。
其主要原因有二:一方面,以 2肾上腺素受体为代表的GPCR家族成员,受体的跨膜区具有复杂的多构象特征。X-射线晶体学或冷冻电镜技术主要用于捕捉受体在特定条件下的最低能量状态。结合多种生物物理学手段,例如溶液核磁共振和电子-电子双共振,研究人员证实未结合配体的 2肾上腺素受体在至少4中不同的构象状态之间平衡转变。另一方面,GPCR家族成员都具有较长的固有无序区(Intrinsically disordered region),主要分布于受体的N端、C端、和受体的ICL3区域。无序区不仅增加了受体构象的不均一性,而且提供了一些线性模体(motif),以方便下游信号蛋白的识别并形成下游信号传递复合物。此外,无序区含有大量的翻译后修饰位点,这使得信号通路的激活和关闭受到地调节。然而,受体的固有无序区在调控受体下游信号通路中的作用鲜有研究。
该研究中,研究人员首先从多个具有较长固有无序C末端的GPCR出发,通过细胞水平的受体组成型激活能力分析,表明截短固有无序C末端后,多个GPCR均表现出较高的组成型激活水平,暗示受体的固有无序C末端在这些GPCR中可能起着自抑制的功能。随后,以 2肾上腺素受体为主要研究对象,发现截短固有无序C末端后受体被不同类型激动剂激活的下游Gs蛋白活性均较野生型更高。蛋白水平的活性测试也进一步证实受体的固有无序C末端可能起着自抑制作用。

图1. 2AR的C末端与Gs竞争结合到受体跨膜核心区
随后,研究人员利用单分子荧光共振能量转移方法,对受体的跨膜区和C末端进行特异性的荧光标记,从而研究受体被激活过程中受体C末端的构象变化。结果显示,单独的受体呈现均一的高FRET状态,当受体与激动剂、Gs蛋白形成传递信号的三元复合物后,受体移动到低FRET状态,暗示受体C末端发生较大的构象变化。进一步研究表明,不同类型的正构配体,能够不同程度的稳定受体-激动剂-Gs蛋白三元复合物。通过单分子荧光共振能量转移技术获得的蛋白复合物的动态性质数据,与蛋白水平的活性研究以及传统细胞水平研究方法获得的正构配体效用(efficacy)数据相吻合。除此之外,单分子荧光共振能量转移方法证实,正向别构调控剂或反向别构调控剂也能对受体-激动剂-Gs蛋白三元复合物的动态性质产生特定的影响,也是通过调节Gs 偶联并形成三元复合物的稳定性。
为了直接研究 2AR的C末端与受体跨膜区的潜在相互作用,研究人员使用溶液核磁共振技术以及蛋白质部分标记技术,将15N同位素标记的C末端与未标记的受体跨膜区融合。
通过特异性地指认C末端氨基酸残基的化学位移信息,对比单独受体和受体-激动剂-Gs蛋白三元复合物中每个氨基酸残基的化学位移和强度变化差异,证实 2AR的C末端中段的部分负电荷残基簇,可能直接参与受体跨膜区的相互作用。随后,研究人员利用分子动力学模拟的方法研究非激活态的受体跨膜核心区与C末端直接的潜在相互作用。结果表明,受体的C末端呈现出多构象的固有无序系综(intrinsically disordered ensemble)。C末端区域的负电荷氨基酸残基与受体多个胞内区域的正电荷残基,包括ICL1、ICL2和ICL3,频繁地相互作用。
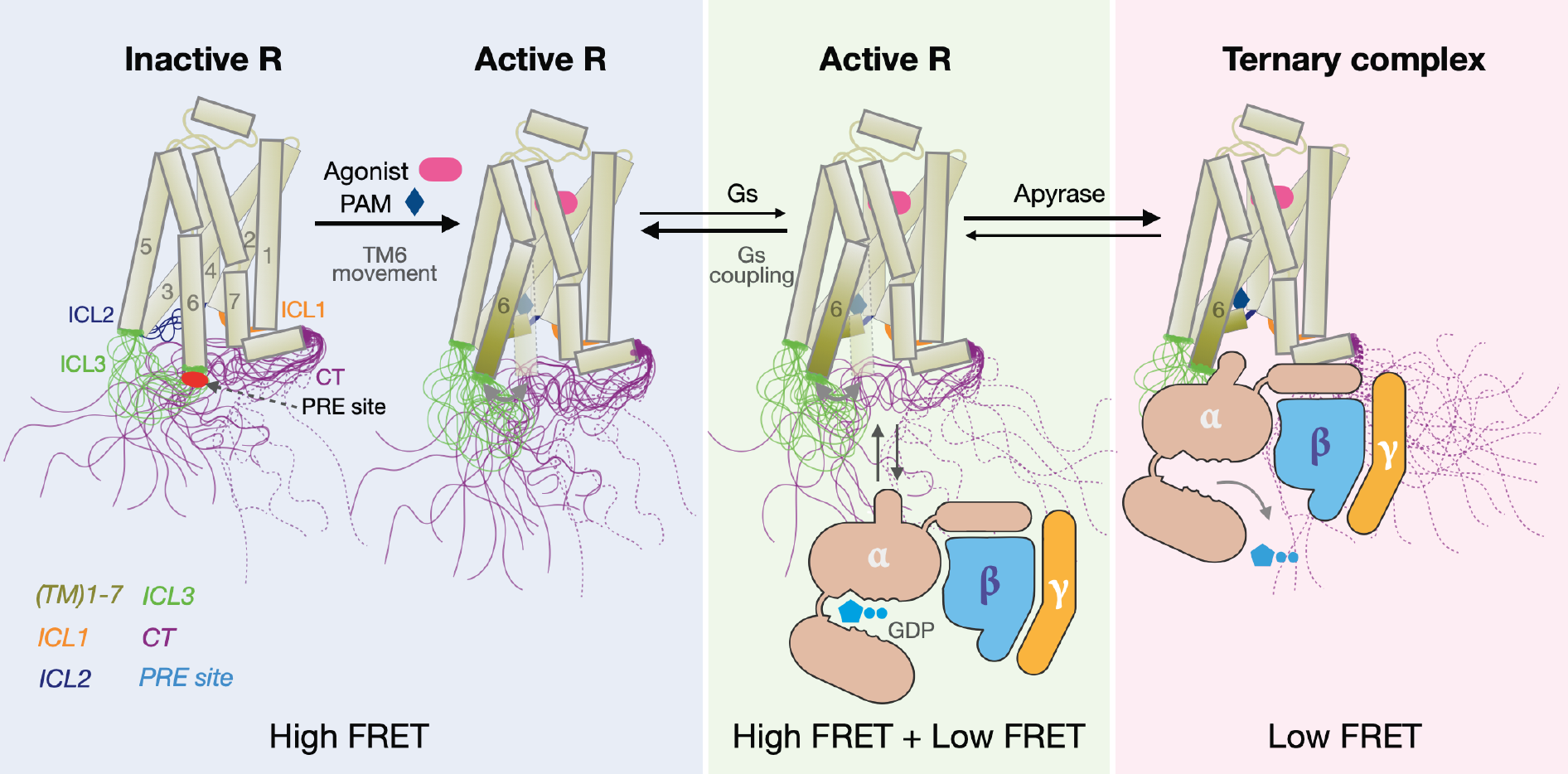
图2. 2AR的C末端动态在Gs蛋白激活中的作用模型
除此之外,研究人员进一步地利用环境敏感型荧光探针标记、氨基酸突突、顺磁弛豫增强技术等,并结合细胞内与细胞外的活性研究体系,验证了 2AR受体的C末端通过与受体跨膜核心区的ICL1、ICL2和ICL3直接相互作用,实现了对受体下游Gs信号通路激活的自抑制效果。
清华大学医学院博士后衡杰博士为本文的第一作者, 斯坦福大学Brian Kobilka教授和清华大学生命科学学院陈春来副教授为本文的共同通讯作者。清华大学医学院已毕业博士生赵佳伟、马秀岩和孙晓鸥博士,清华大学生命科学学院已毕业博士生彭思佳和张璐嘉,北京核磁共振中心金长文课题组牛晓刚博士、李红卫博士和丁洁女博士,中国科学院精密测量科学与技术创新研究院胡蕴菲博士,日本东北大学Asuka Inoue课题组Kouki Kawakami、Tatsuya Ikuta,德国莱比锡大学Peter W Hildebrand课题组Guillermo P rez-Hern ndez、Ramon Guix -Gonz lez等共同参与合作研究。
感谢北京生物结构前沿研究中心,北京市结构生物学高精尖创新中心,清华-北大生命科学联合中心,中国博士后科学,国家委,科技部国家重点研发计划,瑞士国家科学基金会,德国研究基金会,日本医学研究开发机构,日本科学促进会,日本科学技术厅等的经费资助!
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 猪鼻里藏着“抗病毒卫士”!南京农大发现枯草芽孢杆菌 NS12,广谱阻击呼吸道病毒还不易耐药 (2025-10-14)
- Research:肝纤维化有救了?中药成分发现“双面杀手” 精准清除致病细胞 (2025-10-14)
- Science:华人团队揭示溶酶体驱动的长寿的跨代遗传机制,一作将回国加入浙江大学 (2025-10-14)
- 癌症治疗迎新突破!MIT 团队改造出“隐身”CAR-NK 细胞,躲过免疫追杀还降副作用 (2025-10-14)
- Cell子刊:顾晓松/吴俊华/江春平团队开发溶瘤病毒水凝胶系统,防止肿瘤复发 (2025-10-14)
- 《自然·医学》:竟然可以不用减重!10年长期研究结果表明,控好血糖即可有效预防前驱糖尿病进展为2型糖尿病,效果与减重相当 (2025-10-13)
- Nature Biotechnology:抗体工程师的“强迫症”福音——让细胞自己做纯化,这波操作太巧妙了! (2025-10-13)
- Science:重写基因表达法则——转录起始点如何“遥控”数万碱基外的终止密码 (2025-10-12)
- Nature:失衡的天平——解密为何男性膀胱癌风险是女性的四倍 (2025-10-12)
- Science:绘制根系微生物“定居地图” (2025-10-12)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















