《细胞·代谢》:南医大/武大团队发现肝癌代谢重编程的新机制! |
 |
驱动肝细胞癌(HCC)代谢重编程的关键因素找到了!
驱动肝细胞癌(HCC)代谢重编程的关键因素找到了!
近期,南京医科大学王学浩/浦立勇/钱晓峰/王科及武汉大学张鹏团队发表了一篇文章,他们通过大规模转录组数据库和生存相关性筛选,确定了胸苷激酶1(TK1)是HCC代谢重编程的关键驱动因素,下调TK1的表达能延缓HCC的进展。
此外,研究还发现,TK1不仅通过其酶活性和脱氧胸腺嘧啶核苷酸(dTMP)的产生促进HCC的发生,还可以不在酶的作用下直接与蛋白精氨酸甲基转移酶1(PRMT1)结合促进糖酵解,为HCC生长提供能量。
了解TK1的酶依赖性和非依赖性分子机制可以帮助我们开发或制定不同的HCC治疗策略。研究发表在《细胞 代谢》上。

论文首页截图
HCC是世界上最常见的癌症相关死亡原因之一,每年确诊患者达80多万。尽管治疗、手术切除、肝移植等治疗方法能够改善HCC患者预后,但肿瘤复发率仍然很高。因此,找到治疗HCC的新方法和新靶点,变得尤为重要。
代谢重编程是HCC的关键特征。为了迅速扩张自己的领地,肿瘤细胞会改变自己的代谢方式,以确保有足够的营养来满足生长和传播的需要。而针对这种代谢方式改变的治疗方法也为HCC的治疗提供了一个新的方向。
鉴于此,南京医科大学和武汉大学的研究人员将研究的重点放在了找出与HCC代谢重编程有关的基因上。
为了筛选出与HCC进展有关的基因,研究人员从多个公共数据库中选取了样本量(HCC和邻近正常组织)大于150,基因覆盖率较高的数据集进行研究,最终在前5个上调的与HCC发生密切相关的基因中选中了TK1,一方面TK1与恶性肿瘤行为、代谢重编程和不良预后有关,另一方面,TK1是里面唯一一个没有被重视的基因。
与HCC发生密切相关的基因
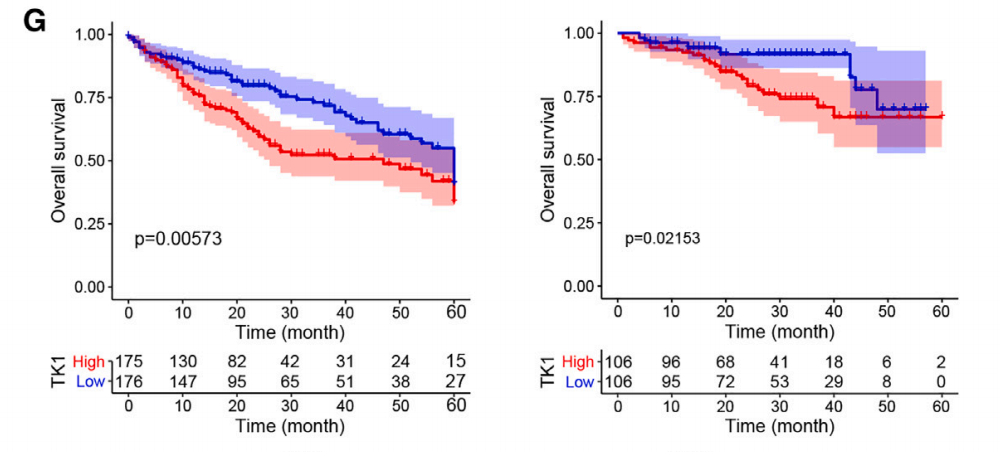
接下来,研究人员在TCGA和ICGC数据库中验证了TK1在HCC中的表达水平的确要高于邻近正常组织。根据TK1表达水平的不同,研究将以上两个数据库中的样本分成了TK1高表达组和TK1低表达组。
结果发现,TK1高表达组个体的生存预后要明显低于TK1低表达组,且TK1高表达组显现出与癌症进展和代谢重编程相关的显著富集生物过程,这也意味着TK1在HCC进展中起着至关重要的作用。
TK1表达与个体的生存预后的关系
在收集了90对HCC样本和对应的邻近组织样本后,研究人员观察到HCC组织中TK1的mRNA表达水平明显高于相邻的正常组织,这进一步验证了TK1在HCC中的表达上调。
那么是什么原因导致TK1在HCC中上调呢?
根据cBioPortal数据库信息,研究人员评估了TK1 mRNA表达与DNA甲基化水平之间的关联。结果发现,TK1基因的表达与DNA甲基化水平呈显著负相关(p=2.0e-14)。
利用亚硫酸氢盐测序法PCR(BSP)和甲基化特异性PCR(MSP)确定HCC标本中TK1启动子的甲基化状态后,研究人员发现,与邻近正常组织相比,HCC中TK1启动子序列发生了低甲基化,且TK1启动子甲基化水平与TK1表达成负相关,这说明,HCC中TK1基因的表达水平上升可能是由于其启动子序列低甲基化造成的。
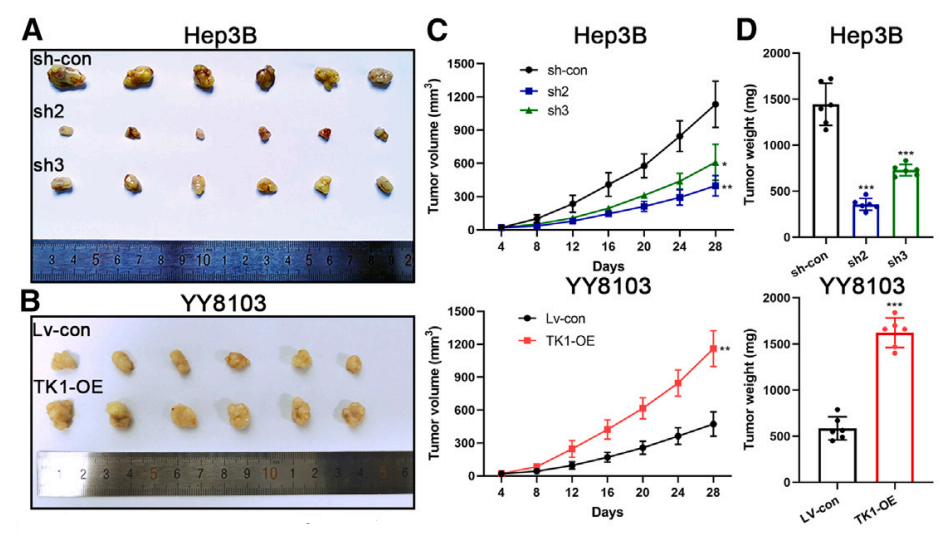
既往研究显示,TK1可促进体外HCC细胞的增殖和迁移,为了评估TK1是否能促进HCC在体内的增殖能力,研究将TK1敲低的Hep3B细胞、过表达TK1的YY8103细胞及其相应的对照HCC细胞接种到裸鼠中。
结果发现,在TK1敲低组中,可以观察到肿瘤体积和重量的下降,TK1过表达组则相反。HE染色、免疫组化分析显示,下调TK1可抑制HCC细胞的增殖能力,提高HCC细胞的凋亡率。在肺转移小鼠模型中,研究人员同样观察到下调TK1可抑制HCC生长以及肺转移。
TK1表达水平与肿瘤大小的关系
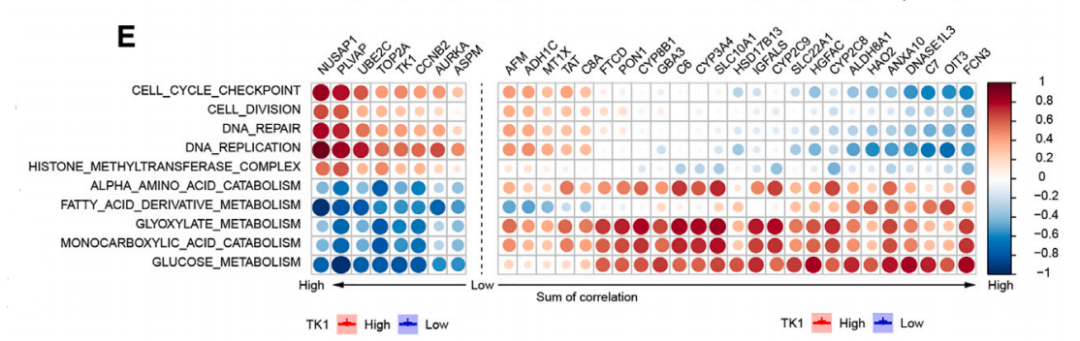
为了进一步揭示TK1在HCC进展中的作用,研究对YY8103细胞系进行了无标记蛋白质组学分析,并通过GO富集分析确定了最显著富集的生物过程是代谢过程。于是,研究人员对YY8103细胞系进行了非靶向代谢组学分析后发现,随着TK1表达水平的改变,代谢谱也发生了变化。KEGG通路分析显示,癌症中心碳代谢(CCM)变化最大。
CCM主要涉及糖酵解、磷酸戊糖途径和柠檬酸循环这三个途径,其中糖酵解是肿瘤细胞中最典型的代谢途径。为了检测TK1对糖酵解的直接影响,研究人员进行了代谢通量分析、18F-FDG PET/CT的测定以及结合临床HCC患者队列数据后发现,无论在体外还是体内,TK1均有助于糖酵解。
我们知道TK1具有典型激酶活性,以往的研究均集中在TK1催化dTMP产生的作用上,为了确定TK1促进HCC进展和糖酵解这一过程是否需要酶的参与,研究人员构建了TK1的野生型(WT)和激酶失活变体(MUT#1),重组到Hep3B细胞和YY8103细胞中。
结果发现,TK1-WT和TK1-MUT#1过表达均增强了肿瘤细胞的增殖、迁移和糖酵解,只不过与TK1-WT相比,TK1-MUT#1作用相对较弱。这说明,TK1不仅可以通过其酶活性,还可以通过与酶无关的机制促进HCC进展和糖酵解。
接下来,研究人员进一步对YY8103细胞进行了免疫共沉淀-质谱联用(IP-MS)分析,再结合蛋白质组学分析结果,确定了PRMT1是与TK1相互作用并受到TK1调节的蛋白质。此外,研究还通过实验验证了TK1与PRMT1之间存在直接相互作用。
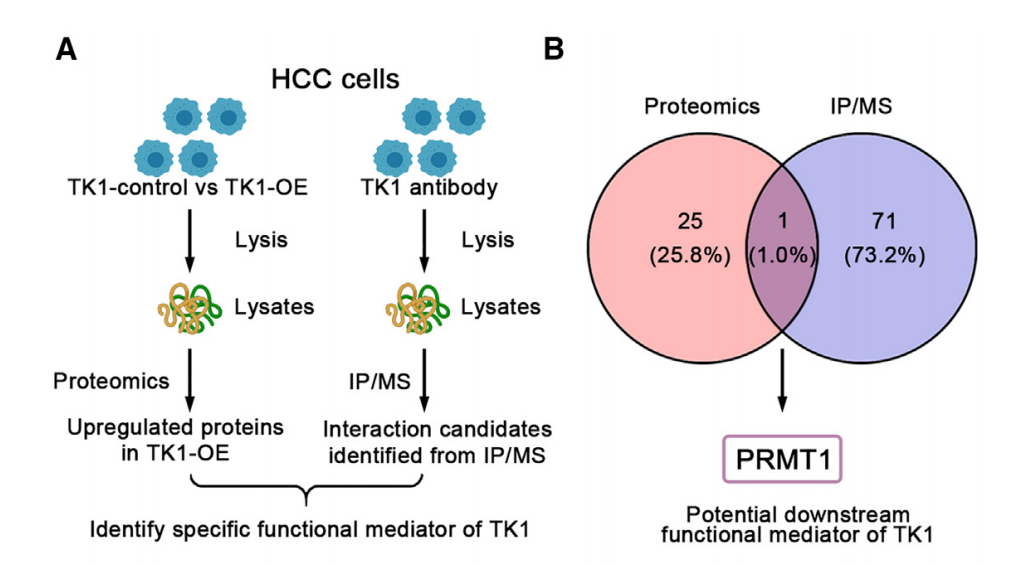
PRMT1是受TK1调节的蛋白质
具体来说,TK1又是如何调控PRMT1的呢?
研究人员用蛋白印记检测了TK1过表达时PRMT1的表达情况,结果发现,当TK1过表达时,PRMT1蛋白表达增加、PRMT1泛素化降低(稳定性增高)。鉴于TK1不能直接影响蛋白泛素化,研究人员推测这中间还存在一个去泛素化酶(DUB)辅助调控PRMT1的表达。
有研究显示,正常情况下,TRIM48可与PRMT1的甲基转移酶结构域相互作用,调控PRMT1的泛素化和降解。在本文中,研究人员发现TK1过表达,显著降低了TRIM48-PRMT1的相互作用,进而减缓了PRMT1的降解。所以研究人员推测TK1通过中断TRIM48介导的泛素化和PRMT1的降解来稳定PRMT1。
为了验证这项发现的临床相关性,研究人员分析了人HCC组织中TK1和PRMT1的表达水平。结果发现TK1的表达水平与PRMT1的表达呈正相关,且TK1或PRMT1低表达的患者普遍预后更好,这说明TK1和PRMT1表达水平可能作为识别HCC患者预后的生物标志物。此外,研究人员利用小鼠模型探究TK1敲除对HCC的治疗潜力。结果发现,TK1敲除后小鼠生存率得到了提升。
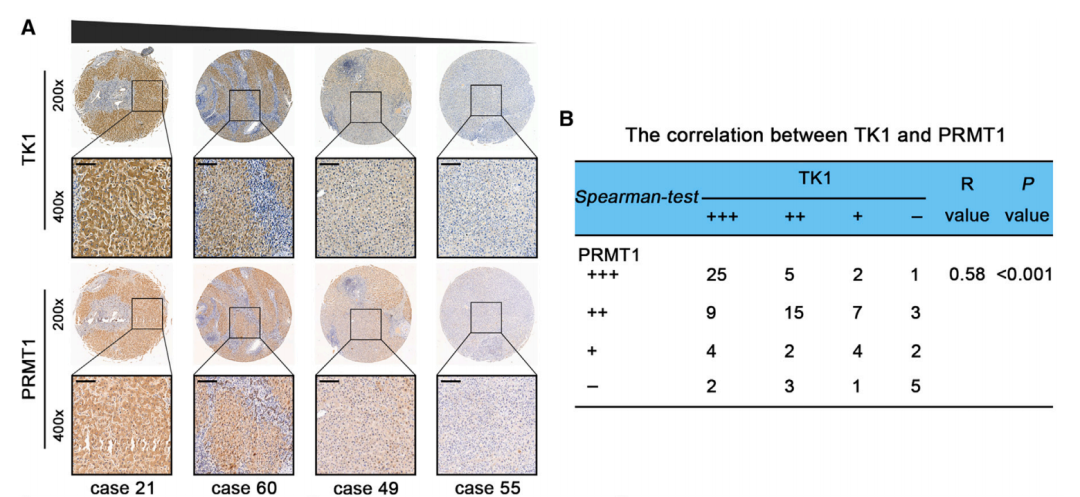
TK1的表达水平与PRMT1的表达呈正相关
总之,该研究不仅发现了HCC代谢重编程的关键驱动因子TK1,还揭示了TK1在HCC发展中的双重作用机制,即通过酶依赖性和不依赖于酶的方式促进HCC恶性进程和糖酵解。未来可以通过靶向这两种分子机制来发展不同的HCC治疗策略。让我们拭目以待吧~
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Lancet HIV:新研究探究HIV影响睡眠的原因 (2025-10-30)
- 孕期怕冷热、孕前甲状腺不好?Nat Commun:孕期生物热应激与孕前促甲状腺激素异常协同加剧早产风险 (2025-10-30)
- Nature:过量的HMGN1蛋白可能解释了唐氏综合征患者的先天性心脏缺陷 (2025-10-30)
- 近期科学家们在肠道微生物研究领域取得的新成果! (2025-10-30)
- 山东深入医养联合示范省建设 托起安康“斜阳红” (2025-10-30)
- 五部分对于展开医养联合匆匆进行为的关照 (2025-10-30)
- NEJM:新研究表明德曲珠单抗有望让重症难治性自身免疫性疾病患者获益 (2025-10-30)
- “脂肪肝”调控找到新靶点!Metabolism:NSD2经H4K20me3-TFEB通路抑制自噬的机制 (2025-10-29)
- 阿尔茨海默病新药研发提速!最新研究打造阿尔茨海默病“微型人脑”,精准模拟大脑病变全过程 (2025-10-29)
- Biomed Pharmacother:从散沫花中提取的一种化学物有望治疗肝纤维化 (2025-10-29)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















