阿伐替尼新适应症获FDA批准 |
 |
来源:医药魔方 2023-05-26 14:51
5月22日,Blueprint Medicines宣布,阿伐替尼(avapritinib)新适应症获FDA批准,用于治疗惰性系统性肥大细胞增多症(ISM)。5月22日,Blueprint Medicines宣布,阿伐替尼(avapritinib)新适应症获批准,用于治疗惰性系统性肥大细胞增多症(ISM)。该产品也是ISM领域首款疗法。

阿伐替尼是一款强效、高选择性、口服针对肥大细胞/生长因子受体(c-Kit)和血小板衍生生长因子受体 (PDGFRA)突变的激酶抑制剂。
2018年6月,基石药业与Blueprint公司达成独家合作和授权协议,获得了阿伐替尼在大中华地区(包括中国大陆、中国香港、中国澳门和中国台湾地区)的独家开发和商业化权利。2021年3月,阿伐替尼在中国获批上市,商品名为泰吉华,用于治疗携带PDGFRA外显子18突变(包括PDGFRA D842V突变)的不可切除或转移性(GIST)成人患者。
FDA此次批准主要是基于全球性II期PIONEER研究的积极结果。该研究是一项随机、双盲、安慰剂对照的临床试验,共纳入212例患者,旨在评估阿伐替尼(25mg,每日1次)治疗经标准治疗后症状控制不充分的ISM患者。研究的主要终点为第6个月ISM症状评估量表(ISM-SAF)评估的总症状评分(ASS)平均变化和II期推荐剂量(RP2D)。
2023年3月,Blueprint在2023年美国过敏、哮喘和学会(AAAAI)年会上公布了该研究的积极结果。
与此前报道的一致,阿伐替尼在主要和所有关键次要终点均具有学显著性与临床意义的重大改善。更新的结果进一步证实了阿伐替尼在病理性肥大细胞负荷、疾病症状 包括TSS、最严重的症状和所有类型症状,以及方面均具有获益。阿伐替尼治疗的患者在各个临床指标上均可见48周内的改善持续加深。
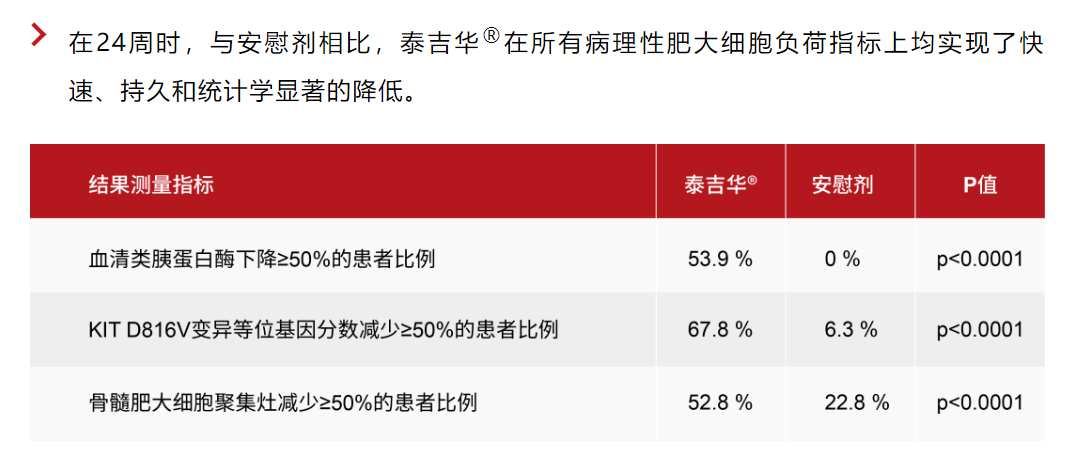
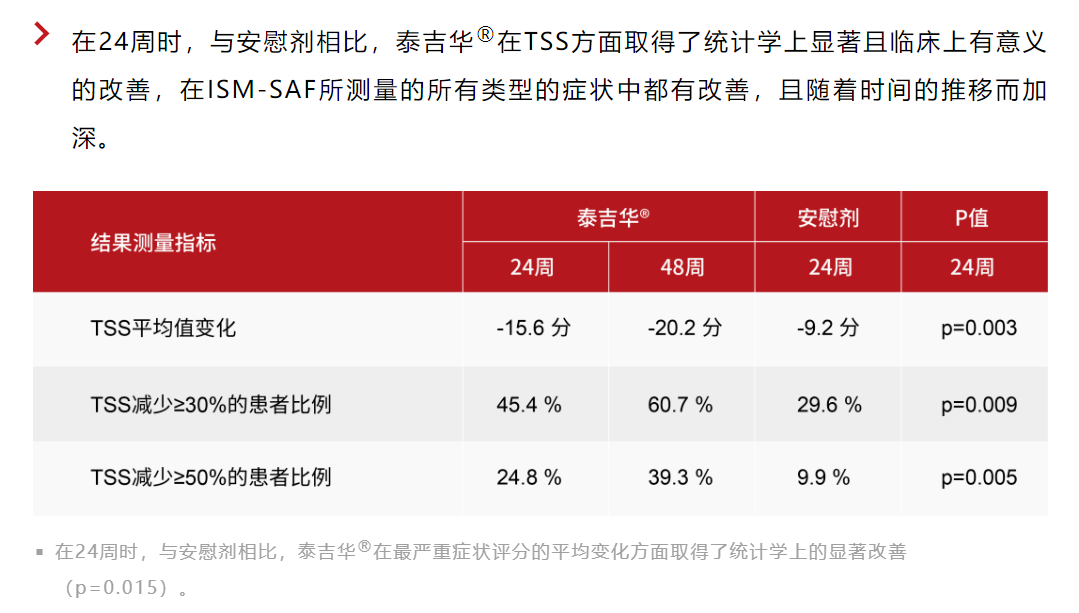
阿伐替尼耐受性良好,安全性优于安慰剂组,阿伐替尼治疗的患者中96%选择在开放标签扩展研究中继续接受该治疗。

系统性肥大细胞增多症(SM)是一种罕见的疾病,大约95%的病例是由KIT D816V突变引起的。肥大细胞失控性的增殖和激活导致多器官系统出现各种慢性、严重和突发症状。
大多数患者为患有非晚期(即惰性与冒烟型)SM,其中绝大多数患者患有ISM。尽管既往曾采用多种药物进行对症治疗,但通常疗效有限,非晚期SM患者的各种症状,包括过敏反应、斑丘疹、瘙痒、腹泻、脑雾、疲劳和骨痛等,仍持续存在。疾病负担对患者的生活质量产生严重的负面影响。患者往往存在对严重、突发症状的恐惧,工作能力或日常活动能力受限,并不得不进行自我隔离以避免不可预测的触发因素。目前,全球范围内尚无批准的治疗非晚期SM的疗法。
少部分为晚期SM患者,有三个亚型,包括ASM、SM-AHN和MCL。除了上述肥大细胞激活症状外,晚期SM还与肥大细胞浸润引起的多器官损伤和不良预后有关。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- “脂质溢出”是元凶?10月30日直播预告:揭秘肥胖代谢共病背后的真相 (2025-10-27)
- Science:我国科学家揭示人类跳跃基因LINE-1靶向结构化DNA来重塑基因组 (2025-10-27)
- 警惕“超级大肠杆菌”!它堵死肠道细胞“自我牺牲路”,新研究破解抗耐药密码 (2025-10-27)
- Nature Genetics:我们沿用20年的小鼠参考基因组,究竟错过了什么?一份T2T图谱的完整答案 (2025-10-26)
- 情感传染!南方医科大学最新论文登上Science封面 (2025-10-26)
- Nature Biotechnology:数据基准与算法创新的双轮驱动——DeepSomatic研究定义的基因组学发现新范式 (2025-10-25)
- Nature:当饥饿遇上荷尔蒙——大脑如何权衡母爱与生存? (2025-10-25)
- 加科思药业在AACR-NCI-EORTC国际大会公布泛KRAS抑制剂(JAB-23E73)临床前数据 (2025-10-24)
- 《柳叶刀》:减肥神药,暗藏护心秘法!迄今最大规模临床试验证实,司美格鲁肽的心脏保护作用与基线肥胖和体重减轻无关,或有独特保护机制 (2025-10-24)
- Cell子刊:脂肪细胞脂解,激活上皮干细胞,促进毛发再生 (2025-10-24)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















