Science:细胞间交流的扩张或会驱动胰腺癌的早期发生和发展 |
 |
来源:100医药网原创 2023-05-31 20:01
来自纪念斯隆凯特琳癌症中心等机构的科学家们通过研究将复杂的遗传工程化小鼠模型与先进的计算方法相结合,成功地绘制出了导致胰腺导管腺癌发生的最早期的细胞状态。对癌症的讨论经常会强调通过改变细胞蛋白质的正常功能来驱动疾病的遗传突变,比如KRAS,其在正常情况下会扮演细胞增殖的开关,但该基因的突变(常见于、和等)通常会导致开关处于开启状态。然而,突变或许仅仅只是故事的一半,这些遗传突变和外部因素(比如导致炎症的组织损伤)之间的相互作用会以一种促进癌症出现和失控生长的方式来重塑细胞的身份和局部环境。
在胰腺癌中,这些改变开始会快速发生,即在组织损伤后的24至48小时内,其发生是可预测的,而且其会明显扩张某些细胞与附近细胞交流和相互作用的能力。近日,一篇发表在国际杂志Science上题为 Epigenetic plasticity cooperates with cell-cell interactions to direct pancreatic tumorigenesis 的研究报告中,来自纪念斯隆凯特琳癌症中心等机构的科学家们通过研究将复杂的遗传工程化小鼠模型与先进的计算方法相结合,成功地绘制出了导致胰腺导管腺癌(PDAC,pancreatic ductal adenocarcinoma)发生的最早期的细胞状态,胰腺导管腺癌是一种最常见的胰腺癌类型。
尽管近年来胰腺癌患者的5年生存率一直在逐步上升,但根据胰腺癌行动网络(Pancreatic Cancer Action Network)数据显示,目前胰腺癌患者的生存率也仅为12%,该疾病通常直到患者癌症晚期才会被发现,而且部分病例的发现还得益于科学家们在治疗其它类型癌症上的进展,因此,目前胰腺癌仍然是全球人群第三大癌症相关死亡的主要原因。这项研究旨在阐明诱发胰腺癌的难以研究的早期细胞事件,而且还有望帮助科学家们找到在疾病早期进行医学干预的潜在机会。
细胞摆脱其原始身份并适应环境的能力称之为可塑性(plasticity),而且这种可塑性会被炎症所增强,研究者表示,这些癌变前细胞能获得发送和接收远多于正常细胞的信号的能力,而且这或许并不是随机发生的,而是具有一定结构性的,当在不同的小鼠机体中进行相关实验时,研究人员就能观察到相同的模式一次又一次地出现。为了研究表达突变版本的KRAS细胞的可塑性的起源和影响,研究人员利用一种遗传工程化的小鼠模型进行研究,对其正常、炎症、癌变前和恶性肿瘤组织进行单细胞分析,旨在准确重现人类胰腺癌发生的方方面面,包括从其最开始发生到最后癌症转移等。
这些模型或许就能促使研究人员捕捉到胰腺上皮细胞从健康状态向恶性状态进展时所发生的最早变化,这种单细胞分析也能促使研究人员有效区分每个进展阶段胰腺癌内部单一细胞亚群的特征,以及其之间的相互作用是如何驱动胰腺癌进展的。这个项目需要大量的计算创新,而这均是由Cassandra来主导的,研究人员必须开发出一系列方法来回答那些通常并不会被问及的关于可塑性、细胞间交流沟通和肿瘤进展的相关问题。
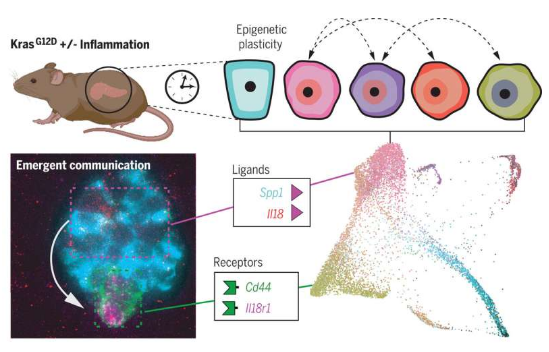
细胞间交流的扩张或会驱动胰腺癌的早期发生和发展。
图片来源:Science (2023). DOI:10.1126/science.add5327
比如,研究人员发明了一种新型分类分数体系来衡量细胞的可塑性,他们发现,增加可塑性或会增强与细胞交流沟通相关基因的表达,比如那些编码配体和受体的基因;基本上,这些就是能促使细胞发送和接收来自环境以及其它细胞的信号的特殊基因,这或许也能促使细胞对正常细胞无法产生反应的信号产生反应,同时其与细胞之间交流沟通的能力也得到了加强,因此,这些细胞周围的免疫系统就会开始发生改变。此外,研究人员还能确定,其中一些相当罕见的亚群细胞或许会转变为主要的通信枢纽,并驱动特殊的反馈回路,从而促进胰腺癌的发生和进展。
Alonso-Curbelo博士表示,这项研究是实验科学和计算科学之间真正的合作,计算模型通过后续实验也得到了验证,比如,成像研究表明,计算方法所提及的相互交流的细胞群体或许就会在组织中彼此之间明显靠近;通过进一步的实验,研究人员就能阐明这种相互交谈或许会驱动癌症的进展。此外,研究人员还开发了新型小鼠模型来特异性地阻断与肿瘤可塑性相关的细胞间信号转导,这些分析结果表明,这些扩张的通讯网络会在小鼠机体中指导胰腺肿瘤的形成。
作为一个整体,研究人员还深入揭示了携带KRAS基因突变拷贝的细胞如何获得可塑性并在受到炎症影响时驱动癌症的进展。最后研究者表示,本文研究提供了一条路线图,其或能帮助开发新型策略,在胰腺癌进展到无法治愈的阶段前来检测甚至预防胰腺肿瘤的形成;同时,理解细胞间交流沟通网络驱动胰腺癌发生的机制也有望帮助开发新型策略,从而早期阻断或减缓癌症甚至更晚期疾病的进展。(100yiyao.com)
原始出处:
CASSANDRA BURDZIAK,DIRENA ALONSO-CURBELO,THOMAS WALLE, et al. , Science (2023). DOI: 10.1126/science.add5327
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 终结持续25年的争论!娄智勇/饶子和等团队合作最新Cell (2025-10-26)
- 上海药物所×临港实验室合作发表Cell论文:基于结构发现新型抗抑郁小分子 (2025-10-26)
- Mol Cancer:阻断甲状腺激素受体为前列腺癌治疗提供了新的途径 (2025-10-26)
- Science子刊:卞修武团队发现增强CAR-T细胞抗肿瘤效果的基因修饰策略 (2025-10-26)
- Nature Biotechnology:直击囊胚“混沌期”——长时程活体成像首次捕捉人类囊胚的染色体分离灾难 (2025-10-26)
- JNCCN:戒烟也应当是癌症治疗的一环!13万名癌症患者数据分析结果显示,癌症确诊后及时戒烟可大幅降低死亡风险,改善手术预后 (2025-10-26)
- NEJM:人工视网膜,帮助老年性黄斑变性患者恢复视力 (2025-10-25)
- 华中师范大学最新Cell子刊论文:开发治疗白血病的多肽类药物 (2025-10-25)
- 《科学》:膳食脂肪重塑昼夜节律!加州大学科学家发现,饮食中不饱和脂肪酸比例会影响昼夜节律,是人体生物钟与季节匹配与否的关键 (2025-10-25)
- 河南中州实验室发表Nature Metabolism论文:揭开大脑髓鞘再生修复的关键 (2025-10-25)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















