NRCO权威综述:克利夫兰医学中心大牛详解对免疫治疗至关重要的抗原呈递机制! |
 |
来源:奇点糕 2023-07-04 14:11
抗原呈递过程对激活T细胞和免疫治疗应答的重要意义已经毋庸置疑,但这一过程中的调控机制实在是非常复杂,迄今学界对此的理解可能还只是冰山一角,相信随着科研探索的不断深入,在未来临床工作者能够基于抗原呈递过先抛一个问题:治疗见效的前提条件是什么?估计各位读者们会从很多种角度,给出各自不同但都算正确的答案。
不过在奇点糕看来,肿瘤抗原被正确识别和处理,然后呈递到CD8+细胞毒性T细胞等免疫效应细胞,也就是抗原呈递机制(Antigen-Presentation Machinery, APM)的顺利完成,才是真正关键的前提条件。
如果抗原呈递过程都不顺畅,那抗应答就会 两眼一抹黑 ,不知道敌人是什么、位置在哪里,免疫治疗的破敌制胜又从何谈起呢?可惜,恶性肿瘤之所以会发生和发展,往往就是APM流程有问题,需要针对性的干预手段。
近期在《自然评论 临床肿瘤学》上,免疫治疗领域的著名大咖Timothy A. Chan,与两位克利夫兰医学中心(Cleveland Clinic)的同事就共同撰文,深度了免疫治疗过程中与抗原呈递有关的分子和基因调控机制,并剖析了相关机制对免疫治疗结局的影响[1]。大咖出品,必读好文!

论文首页截图
肿瘤细胞抗原的呈递机制
说到抗原呈递,就肯定绕不开MHC 主要组织相容性复合体这个概念,人体内的MHC主要分为MHC-I和MHC-II两类,它们的编码基因和结构存在差异,此外还有以下几点区别:
MHC-I存在于有核细胞的表面,与长度为8-11个氨基酸的结合肽结合后,再被CD8+T细胞的T细胞受体(TCR)识别;
而MHC-II则存在于抗原呈递细胞和造血细胞表面,其结合肽相对更长(10-16个氨基酸),且识别MHC-II复合体的主要是CD4+辅助性T细胞。
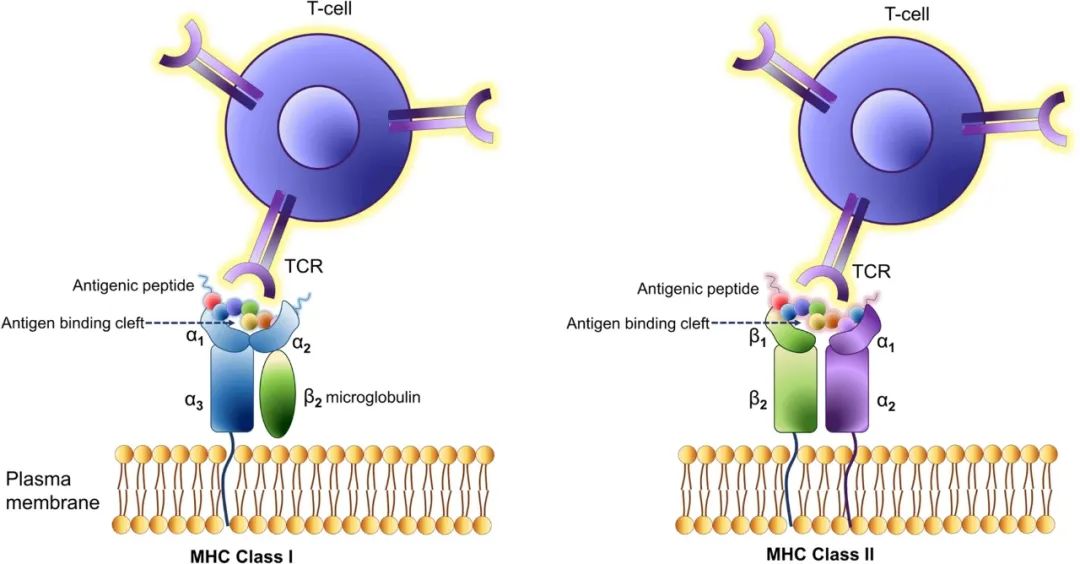
MHC-I和MHC-II的区别
(图片来源:Journal of Hematology Oncology)
癌细胞内的抗原处理和呈递围绕着MHC-I类分子展开,具体流程可以分为三个步骤,即:1)抗原蛋白经蛋白酶降解处理,变为长度9-16个氨基酸的多肽;2)抗原多肽被转运到内质网,经进一步剪裁并在内质网氨肽酶1(ERAP1)等酶类作用下,被装配为MHC-I类分子-多肽复合物;3)复合物被转运到细胞表面表达。
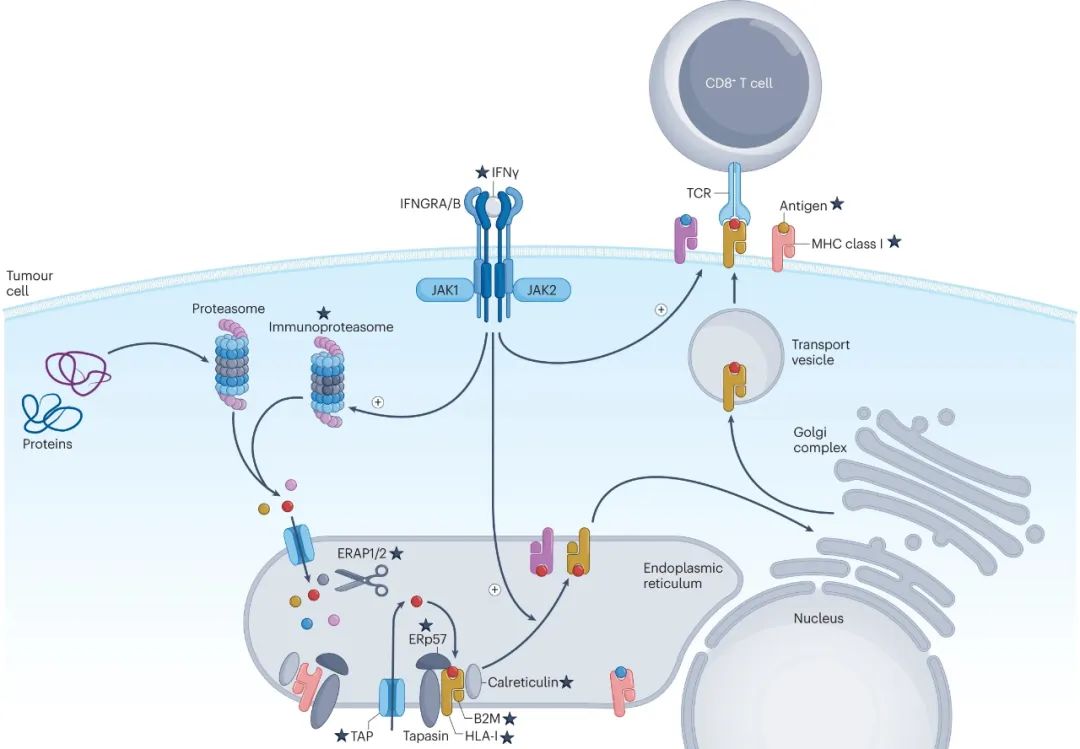
癌细胞内的抗原处理和呈递过程
接下来,树突状细胞(DCs)等专职的抗原呈递细胞(APCs),就会通过胞吞/内吞/胞啃作用等方式摄取MHC-I类抗原,并在细胞内经胞质途径或液泡途径(cytosolic/vacuolar pathway)进行加工,这是进一步激活幼稚CD8+T细胞的关键,DCs介导的抗原交叉呈递(Cross-Presentation),对免疫治疗更是意义重大[2]。
抗原呈递机制的 变
如果抗原呈递机制能够顺利完成,那么CD8+细胞毒性T细胞就会准确迁移到肿瘤部位,有效识别MHC-I类抗原并杀伤癌细胞,但事情总不会这么简单,形形色色的影响因素,例如编码MHC-I分子或其它APM组分的基因变异、转录和翻译后调节以及表观遗传改变,都会影响抗原呈递对免疫应答的激活效果。
HLA等位基因变异
编码MHC-I类分子重链的HLA-A/B/C基因存在很强的多态性,每个患者的HLA表型都会对抗原呈递过程和免疫治疗应答产生影响,如2018年登上《科学》的一项标志性研究显示,非小细胞()患者的HLA基因杂合性越强,从免疫单药治疗中获益的可能性就越大[3],后续也有多个研究得到了相似的结论。
部分特定的HLA超型(Supertype)也可用于预测免疫治疗应答,如在黑色素瘤患者中,HLA-B44超型与免疫治疗后患者较长的总生存期(OS)相关,HLA-B62超型则与较短的OS相关,原因可能是HLA超型影响TCR与MHC-I类分子的相互作用;同样参与抗原呈递过程的生物标志物还有HLA杂合性缺失(HLA LOH)。
对HLA表达的调控
转录、翻译和翻译后的许多调节机制都会影响HLA表达,进而影响抗原呈递过程,例如干扰素- (IFN )就可通过激活JAK-STAT通路,激活干扰素调节因子1(IRF1)以刺激NLRC5的表达,进而上调HLA-A/B/C基因的表达,影响CD8+T细胞激活乃至患者预后。
与IFN 有类似调节作用的转录因子或信号通路还有不少,多种miRNA也可以在转录后对HLA基因的表达进行调控;而MHC-I类分子完成翻译后,癌细胞也可通过自噬、内质网相关降解等途径,减少自身表面的MHC-I类分子表达。
抗原呈递过程其它组分的改变
除HLA基因外,与处理、转运和呈递抗原表位(Epitope)过程有关的多个基因也可能发生变异,例如弥漫大B细胞中就常见B2M基因的失活变异,其介导的癌细胞表面MHC-I类分子表达异常,就会影响抗原呈递和抗肿瘤免疫应答。
表观遗传和表观转录调控
表观遗传沉默是癌症发生发展过程中减少HLA表达、促进免疫逃逸的重要机制之一,例如系统癌症中常见的HLA基因启动子区域高甲基化,就与MHC-I类分子的表达下调、抗原呈递受限有关,但该领域的研究目前尚不十分深入。
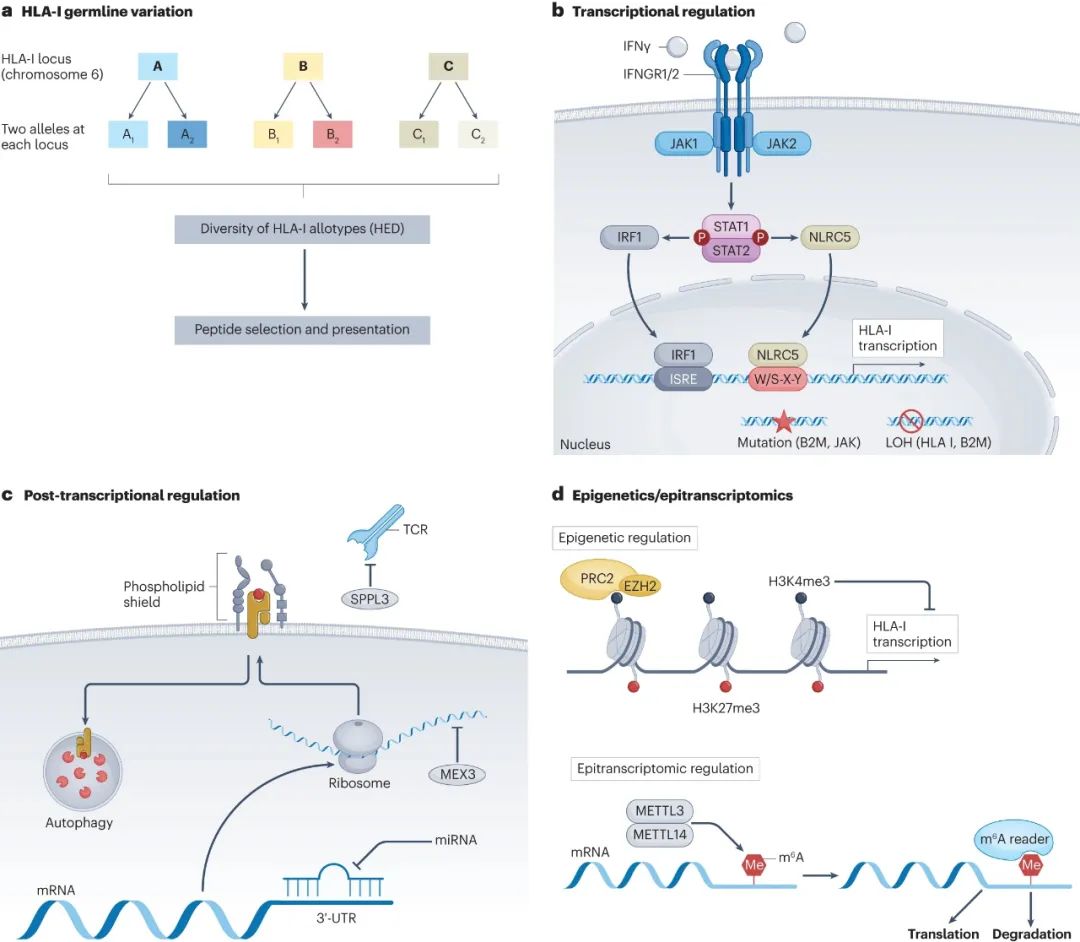
一图汇总各种抗原呈递机制相关改变
抗原呈递过程与免疫检查点抑制剂临床应答的关系
前文已介绍了一些与抗原呈递过程有关的可用标志物,如HLA基因杂合性、HLA超型等,与此类似的标志物还有HLA进化多样性(HED),它们往往还能与肿瘤突变负荷(TMB)等已知标志物联合应用以提高预测效能[4];借助机器学习技术,学界还分析了HLA等位基因变异特征与免疫治疗应答的关系。
对癌症基因组图谱计划(TCGA)数据的分析显示,大多数免疫原性肿瘤存在HLA-I类基因表达上调,免疫治疗收效最好的 免疫炎症 型肿瘤往往还合并HLA-II类基因上调,而MHC-I类分子表达缺失则常提示免疫治疗效果不佳。
但近年来的多项研究显示,CD4+T细胞也可识别部分肿瘤细胞表面存在的MHC-II类抗原,进而激活一定程度的抗肿瘤免疫应答,CD4+T细胞的这种作用长期以来确实被低估了,因此改善MHC-II类抗原的呈递也确实是一种治疗思路。此外,化疗等手段在免疫联合治疗中对抗原呈递过程的影响,也非常值得进一步探索。
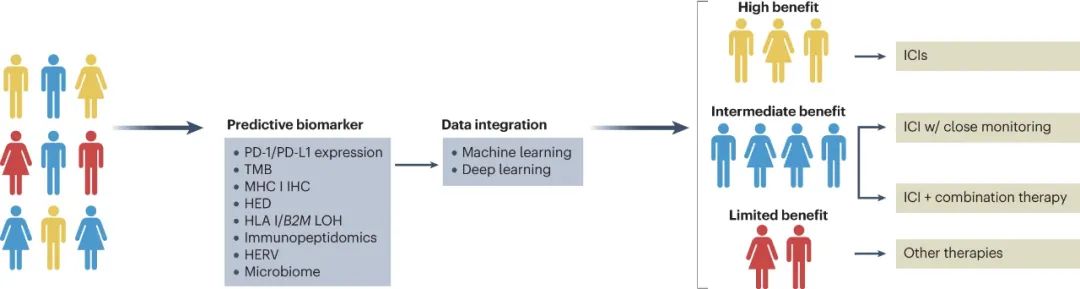
如何借助抗原呈递过程指导免疫治疗
而在PD-1/L1抑制剂和CTLA-4抑制剂之后,针对其它免疫检查点的众多抑制剂正蓄势待发,它们对抗原呈递过程的影响当然也需要阐明。细胞疗法、TCR-T疗法等广义上的免疫治疗中,同样少不了抗原呈递的参与,此处就不做详述了。
总结
抗原呈递过程对激活T细胞和免疫治疗应答的重要意义已经毋庸置疑,但这一过程中的调控机制实在是非常复杂,迄今学界对此的理解可能还只是冰山一角,相信随着科研探索的不断深入,在未来临床工作者能够基于抗原呈递过程的动态变化,指导免疫治疗的使用。
参考文献:
[1]Yang K, Halima A, Chan T A. Antigen presentation in cancer mechanisms and clinical implications for immunotherapy[J]. Nature Reviews Clinical Oncology, 2023.
[2]S nchez-Paulete A R, Teijeira A, Cueto F J, et al. Antigen cross-presentation and T-cell cross-priming in cancer immunology and immunotherapy[J]. Annals of Oncology, 2017, 28: xii44-xii55.
[3]Chowell D, Morris L G T, Grigg C M, et al. Patient HLA class I genotype influences cancer response to checkpoint blockade immunotherapy[J]. Science, 2018, 359(6375): 582-587.
[4]Chowell D, Krishna C, Pierini F, et al. Evolutionary divergence of HLA class I genotype impacts efficacy of cancer immunotherapy[J]. Nature Medicine, 2019, 25(11): 1715-1720.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 鹏瑞利集团、陆家嘴管理局和陆家嘴集团签订三方合作战略协议 拟设立上海首家外商独资三级综合医院 (2025-07-31)
- 为什么女朋友/老婆总爱改主意或纠结?最新Sci Adv:大脑中LINC00473对女性影响显著,使其敏锐地权衡沉没成本和风险收益 (2025-07-31)
- PLoS Comput Biol:人体生物钟在较高温下通过扭曲基因活动来保持24小时的节律 (2025-07-31)
- 喝含糖饮料竟会“改写”肠道细菌 DNA?Nat Commun:软饮料会影响肠道细菌和免疫系统之间的交流 (2025-07-31)
- Cell:指出一篇与冠状病毒抗病毒药物开发相关的研究存在缺陷 (2025-07-30)
- 《科学》:糖尿病治疗重大突破!科学家开发新型分子胶,可将RAS与PI3K亲和力提高500倍,无需胰岛素也可降糖 (2025-07-30)
- 打破昼夜节律局限!Nat Neurosci:CLOCK 基因揭秘人类大脑认知超凡进化的关键密码 (2025-07-30)
- ACS Nano:浙江大学研究发现,人类卵泡液和精浆中存在纳米塑料,影响受精能力和精子质量 (2025-07-30)
- Cell Genomics:AI 助力抗癌新突破!机器学习模型精准预测肿瘤侵袭性 (2025-07-30)
- Cell:我国科学家利用人工智能驱动的策略实现了蛋白质的快速高效进化 (2025-07-29)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















