Nature:意外!病毒 ADP 核糖转移酶将RNA与宿主蛋白偶联在一起 |
 |
来源:100医药网原创 2023-09-20 15:20
在此之前,人们一直认为 RNA 和蛋白只是在细胞过程中发生短暂的相互作用。在一项新的研究中,来自德国马克斯-普朗克陆地微生物研究所的研究人员发现,事实并非如此:细菌病毒---也称为噬菌体---在发育周在此之前,人们一直认为 RNA 和蛋白只是在细胞过程中发生短暂的相互作用。在一项新的研究中,来自德国马克斯-普朗克陆地微生物研究所的研究人员发现,事实并非如此:细菌病毒---也称为噬菌体---在发育周期中会将特定的 RNA 与宿主蛋白 粘合 在一起。这种称为RNAylation的化学修饰可能为噬菌体疗法或药物开发开辟新途径。相关研究结果发表在2023年8月31日的Nature期刊上,论文标题为 A viral ADP-ribosyltransferase attaches RNA chains to host proteins 。
美国著名生物学家Linus Pauling曾写道, 生命是分子之间的关系。蛋白和 RNA之间的相互作用影响着翻译、遗传信息的修复以及细胞构成单元的运输。这些相互作用是 RNA 与 RNA 结合蛋白之间基于特定 RNA 结构或序列的瞬时接触。 如今,这些作者发现,蛋白和 RNA 也可以通过所谓的共价键紧密结合在一起。
噬菌体是 快速杀手
这项新的研究对细菌和噬菌体系统进行了研究。噬菌体攻击特定的细菌,比如感染大肠杆菌的 T4 噬菌体。T4 是一种 快速杀手 :细菌细胞在感染开始后 20 到 30 分钟就会被摧毁。这比的作用还要快。随着抗生素耐药性的增加,噬菌体疗法正被视为治疗细菌感染的潜在替代疗法。
为了感染细菌,噬菌体 T4 进化出了令人着迷的策略。入侵后,它使用三种不同的 ADP 核糖转移酶(ADP-ribosyltransferase, ART)作为生物催化剂。通过将部分辅酶烟酰胺腺嘌呤二核苷酸(NAD)连接到蛋白上,这些 ART 可以修饰 30 多种宿主蛋白。这使得噬菌体能够对细菌重编程并杀死它们。
NAD-RNA 连接宿主蛋白和噬菌体研究
论文共同通讯作者、马克斯-普朗克陆地微生物研究所的Katharina H fer研究 RNA 的功能已有一段时间。她对 NAD-RNA (携带NAD的RNA)尤其感兴趣。八年前,她和海德堡大学的同事们已发现细菌中存在这种类型的 RNA。从那时起,NAD-RNA 以多种不同的形式和大小出现在不同的生物群体中,但它们的生物学意义仍不明确。
H fer想知道,像 T4 噬菌体使用的ART是否不仅能将 NAD 而且能将 NAD-RNA 连接到蛋白上。为了回答这个问题,这些作者不得不自己开发了许多方法。但后来情况逐渐明朗:T4噬菌体的ART ModB不仅能接受NAD,还能接受NAD-RNA作为底物---无论是在试管中还是在活体系统中。他们将这种新颖的反应---整个 RNA 与蛋白的结合---称为 RNAylation。这是一种全新的天然 RNA -蛋白相互作用概念。
RNAylation 可能是一种控制细胞资源的机制
但为什么 T4 噬菌体要使用 RNAylation 呢?显然,这一过程对于噬菌体的高效感染至关重要,因为缺乏 ModB 的 T4 噬菌体突变体杀死细菌的速度要慢得多。
这些作者能够证实在活细胞中,ModB 能将不同的 RNA 与参与翻译的细菌蛋白特异性结合。
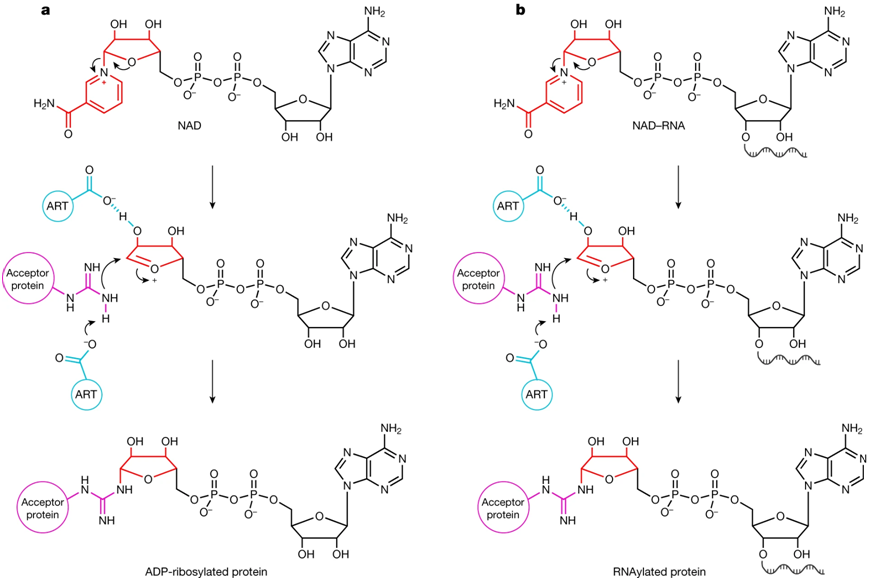
ADP核糖基化的机制和建议的RNAylation。图片来自Nature, 2023, doi:10.1038/s41586-023-06429-2。
论文第一作者Maik Wolfram-Schauerte说, RNAylation可能是噬菌体策略的一部分。将细菌 RNA 附着到核糖体上可能会阻止细菌蛋白的翻译,从而使噬菌体能够调节自身蛋白的生物合成。
RNAylation作为合成生物学的潜在新工具
为了研究 RNAylation 的分子机制,H fer 开始与海德堡大学和哥廷根马克斯-普朗克多学科科学研究所的研究人员合作。
H fer 解释说, 我们的研究结果不仅扩展了以前对噬菌体发育周期的描述,还指出了噬菌体在生物学上的全新作用。它们为 NAD 修饰的 RNA 指明了一种全新的生物学作用,即激活 RNA,从而使得酶将RNA转移到蛋白上。这也开辟了新的研究途径。
例如,RNAylation 未来可能成为合成生物学的一种工具。作为一种 分子胶水 ,它可能用来形成特定的 RNA-蛋白偶联物,从而组合利用蛋白和核酸的特性。
但是,目前仍有许多未解之谜。H fer 解释说, 一些 ART 接受 NAD-RNA,另一些则不接受,这就提出了确切机制的问题。困难在于这种修饰相当大而且复杂。在试管中,RNAylation相对容易检测,但在体内,靶蛋白和 RNA 的多样性使研究具有挑战性。为了阐明 RNAylation 的功能,我们需要开发新的方法,在活体中研究我们的具体问题。 ( 100yiyao.com)
参考资料:
1. Maik Wolfram-Schauerte et al. . Nature, 2023, doi:10.1038/s41586-023-06429-2.
2. Viruses glue RNA to proteins
https://www.mpg.de/20727634/viruses-glue-rna-to-proteins?c=153449
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Nature:李芝倩等编辑 “隐形基因开关” 使蚊子不再传播疟疾 (2025-08-04)
- 人类也拥有冬眠“超能力”?《科学》背靠背揭开冬眠秘密,或有助于多种疾病治疗 (2025-08-04)
- 8.5亿美元BD交易背后,乐普生物的“成长密码” (2025-08-04)
- GSK 2025H1:肿瘤业务收入大涨,HIV业务保持强势,公司2031年目标锁定400亿+英镑 (2025-08-04)
- Cell:演化的“加速器”,癌症的“催化剂” 揭秘转录因子一体两面的遗传功能 (2025-08-04)
- AI智能体登上Nature子刊!华大智造发布靶向测序引物设计工具PrimeGen (2025-08-04)
- 《柳叶刀》子刊:日行七千步,有八大好处!迄今最大规模/最全面研究发现,日行七千步与八种健康风险最高降低47%相关 (2025-08-04)
- 《循环》:多起/坐,降血压!临床研究结果显示,增加站-坐转换次数、改善久坐行为,可有效降低绝经后女性血压 (2025-08-04)
- Nature:徐墨/高璞合作揭示过敏原诱导免疫应答的共通分子机制 (2025-08-04)
- 四部分发文规范“自媒体”医疗科普信息宣布传达行动 (2025-08-04)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















