Science子刊:揭示Daam1在调节肠道干细胞分化为潘氏细胞中起着关键作用 |
 |
来源:100医药网原创 2023-12-25 14:33
干细胞可以分化为新的细胞来取代死亡和受损的细胞。但在特定情况下,干细胞如何决定成为哪种类型的细胞?在一项新的研究中,来自奥地利科学院分子生物技术研究所和韩国基础科学研究院等研究机构的研究人员利用肠道类可以分化为新的细胞来取代死亡和受损的细胞。但在特定情况下,干细胞如何决定成为哪种类型的细胞?在一项新的研究中,来自奥地利科学院分子生物技术研究所和韩国基础科学研究院等研究机构的研究人员利用肠道类器官(intestinal organoids),发现了一个称为Daam1的新基因,它在肠道分泌细胞的发育过程中起着至关重要的作用。这一发现为癌症研究开辟了新的视角。相关研究结果发表在2023年11月24日的Science Advances期刊上,论文标题为 Intestinal Paneth cell differentiation relies on asymmetric regulation of Wnt signaling by Daam1/2 。

我们的身体在某些方面就像汽车一样,需要定期检查和修理才能保持正常运转。就我们的身体而言,任何受损或死亡的细胞都需要被替换,以保持器官的功能。这种替换要归功于组织驻留的成体干细胞。
胚胎干细胞可以在体内形成任何细胞类型,与之相比,成体干细胞只会形成其所属组织中的细胞类型。但是,组织干细胞如何知道要产生哪种细胞类型呢?这些作者决定利用肠道干细胞研究这个问题。
肠道---持续不断的建筑工地
论文共同第一作者、奥地利科学院分子生物技术研究所Bon-Kyoung Koo实验室博士后研究员Gabriele Colozza解释说, 在我们的肠道中,细胞暴露在极端条件下。 机械磨损、酶和不同的pH值都会影响肠道细胞。反过来,肠粘膜中的干细胞会通过分化形成新的肠道细胞。
受损细胞必须被替换,但干细胞自我更新和分化成其他细胞类型之间存在着微妙的平衡:干细胞不受控制地增殖可能会导致的形成;另一方面,如果过多的干细胞发生分化,组织中的干细胞就会枯竭,最终无法自我更新。
这种平衡通过信号传导通路和反馈回路进行微妙调整,从而使细胞能够相互沟通。其中一种重要的信号传导通路叫做Wnt。Wnt通路因其在胚胎发育中的作用而闻名,如果不加以控制,过度活跃的Wnt通路会导致细胞过度分裂并形成肿瘤。
已确定的分子搭档
Rnf43 是一种众所周知的 Wnt 信号拮抗剂,它能使 Wnt 处于受控状态,最早由 Koo 发现。在这项研究之前,人们已知道Rnf43靶向Wnt受体Frizzled,并对它进行标记使之遭受降解。
我们想知道Rnf43是如何起作用的,以及反过来是什么在控制Rnf43并帮助它调节Wnt信号转导。 这些作者从早先的研究中得知,Rnf43本身不足以降解位于质膜上的Wnt受体Frizzled。
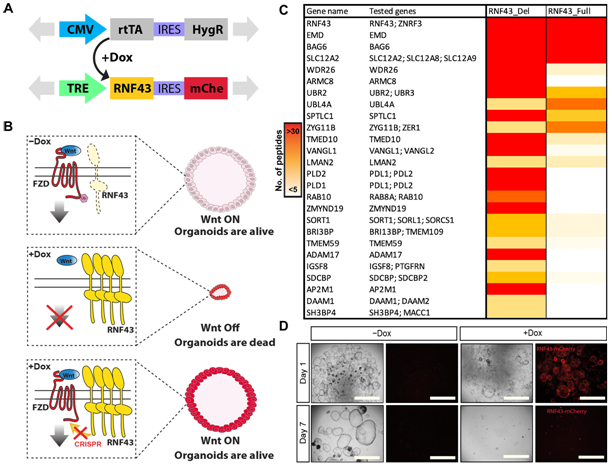
图片来自Science Advances, 2023, doi:10.1126/sciadv.adh9673。
在我们的项目中,我们利用生化实验来确定哪些蛋白与Rnf43相互作用。 Rnf43的一个关键分子搭档是蛋白Daam1。为了了解Daam1如何调控Rnf43并影响它在其中发挥作用的组织,Colozza转向了肠道类器官。
Colozza补充说, 我们发现,Daam1是Rnf43激活所必需的,因此Rnf43完全可以调节Wnt信号。在细胞中的进一步研究表明,Rnf43需要Daam1将Wnt受体Frizzled移入称为内体(endosome)的囊泡中。Frizzled从内体穿梭到溶酶体,在那里被降解,从而抑制Wnt信号传导。
肠道类器官是由成体肠道干细胞培育而成的三维细胞培养物,使得这些作者能够模拟肠道粘膜。对Colozza来说,肠道类器官是了解Rnf43和Daam1如何影响肠道干细胞自我更新和分化保持微妙平衡的机会。 我们发现,当我们敲除Rnf43或Daam1时,肠道类器官就会长成肿瘤样结构。即使我们移除它们通常依赖的生长因子,如R-spondin,这些肿瘤样结构仍会继续生长。
开启潘氏细胞(Paneth cell)的形成
当Colozza在小鼠组织中追踪这一结果时,这些作者大吃一惊。 当 Rnf43 缺失时,肠道会长出肿瘤,这是意料之中的。但当缺少 Daam1 时,却没有肿瘤生长。我们对这种惊人的差异感到困惑:在肠道类器官中表现相似的相同通路中的因子缺失,怎么会导致如此不同的结果?
通过仔细观察肠道,Colozza发现,缺乏 Rnf43 的肠道充满了一种特殊的分泌细胞---潘氏细胞。另一方面,缺乏Daam1的肠道中没有多余的潘氏细胞。潘氏细胞会分泌生长因子,如Wnt,从而刺激细胞分裂。
Daam1是有效形成潘氏细胞所必需的。当Daam1活跃时,肠道干细胞通过分化形成潘氏细胞。当Daam1不活跃时,肠道干细胞会分化成另一种细胞类型。
肿瘤通过改变它们所在的微环境来生长
这些分子结果与潘氏细胞之间的这种联系解释了肠道组织与肠道类器官之间令人费解的差异。 在肠道类器官培养中,我们提供生长因子,因此敲除Rnf43和Daam1都会导致肿瘤样结构产生。但在肠道组织中,没有我们提供的生长因子。相反,潘氏细胞提供生长因子,比如Wnt,并为肠道干细胞的生存和分裂创造适当的条件。
当缺乏潘氏细胞时---例如当Daam1不活跃,无法驱动肠道干细胞成为潘氏细胞时,肠道干细胞就不会大量分裂。但是,当潘氏细胞过多时---比如在缺乏Rnf43的肠道中,过多的生长因子会导致肿瘤的形成。
Colozza及其同事们的研究首次从遗传学角度证实,非经典Wnt通路的成员Daam1对形成潘氏细胞非常重要,并直接参与了这种关键分泌细胞的发育。这些研究结果还揭示了肠道干细胞微环境的重要性。 我们发现会改变它们的微环境,影响它们的支持环境,使它们能够更好地生长。 ( 100yiyao.com)
参考资料:
Gabriele Colozza et al. . Science Advances, 2023, doi:10.1126/sciadv.adh9673.
Decoding cell fate: Key mechanism in stem cell switch identified
https://medicalxpress.com/news/2023-11-decoding-cell-fate-key-mechanism.html
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Cell:人类蛋白质组学研究绘制了13个器官的衰老特征 (2025-08-31)
- Nature子刊:一种关键蛋白复合物驱动阿尔茨海默病中的神经细胞死亡 (2025-08-31)
- Cell:我国科学家揭示Slurp1基因让动物适应陆地行走 (2025-08-31)
- 复星医药再次授权出海一款炎症疾病候选药物,交易总额最高可达6.7亿美元 (2025-08-31)
- Nature Medicine:跨越物种的呼吸——一枚猪肺在人体胸腔内的九日奇航 (2025-08-31)
- Blood:新研究揭示炎症性肠病导致血栓机制 (2025-08-30)
- 世界首创!我国学者创造多彩发光植物,晒太阳“充电”,成本仅10块钱 (2025-08-30)
- Cell:新研究测定了从肠道微生物进入人体的代谢产物的数量 (2025-08-29)
- 破解 40 年医学谜题!Gut:吸烟为何“护溃疡性结肠炎却伤克罗恩病”? (2025-08-29)
- Cell子刊:中南大学湘雅医院张伟团队发现能够增强癌症免疫治疗的肿瘤内细菌 (2025-08-28)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















