司美格鲁肽:可通过改善炎症状态降低ASCVD的发生风险! |
 |
来源:网络 2024-04-22 17:45
2017年,在全球范围内约1.26亿人受心血管动脉粥样硬化性心血管疾病(ASCVD)影响,其中,中国ASCVD患病率达1612/10万。2017年,在全球范围内约1.26亿人受心动脉粥样硬化性心(ASCVD)影响,其中,中国ASCVD患病率达1612/10万。1990~2019年中国缺血性心脏病及的死亡率呈明显上升趋势,ASCVD的疾病负担日益沉重,明确ASCVD发病机制及采取相应的应对策略十分重要[1]。
动脉粥样硬化(AS)是在动脉壁上形成粥样斑块,造成动脉狭窄。炎症在AS斑块的发生发展中起重要作用。AS的发病机制多样且复杂,研究表明AS的发病学说主要有炎症、脂质浸润、氧化应激、内皮损伤等。炎症已成为连接脂质和AS的桥梁(图1)。
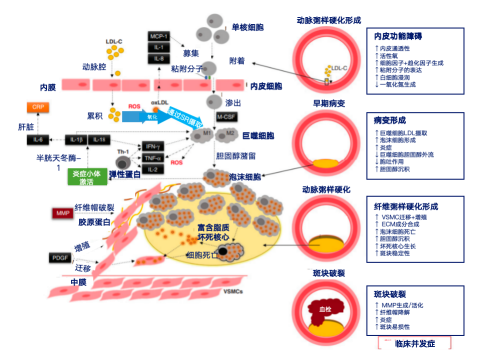
图1. 炎症是连接脂质和动脉粥样硬化的桥梁
早期,血管内皮损伤、脂质代谢异常、血流动力学损伤是AS主要原因。随着疾病的进展,巨噬细胞、淋巴细胞、树突状细胞、内皮细胞、血管平滑肌细胞等炎性细胞和细胞因子参与其中,大量的低密度被修饰成氧化低密度脂蛋白(oxLDL)并在血管内壁积聚,促进斑块的发展。单核细胞分化为巨噬细胞,吞噬oxLDL沉积物并转化为泡沫细胞[2]。
晚期,大量炎性细胞因子浸润血管壁,分泌基质金属蛋白酶降解斑块细胞外基质中的胶原纤维,导致斑块破裂、出血、形成。浸润肥大细胞有助于形成促炎环境,和血管内皮细胞释放多种促炎介质,维持和增强局部炎症和AS病变的发展[2]。
(一)与AS发展相关的炎症标志物
1.C反应蛋白(CRP)
CRP是一种由肝脏产生的蛋白质,主要由白介素-6(IL-6)、白介素-1 (IL-1 )和肿瘤因子- (TNF- )等炎症介质刺激产生。当组织受损时,炎症反应系统被激活,巨噬细胞在受损组织中积累并释放大量的IL-6和TNF- ,诱导肝脏合成大量的CRP。CRP可导致血管内皮细胞损伤,阻止血管内皮细胞(VECs)修复和增殖。另外,CRP(mCRP)作为不溶性单体,通过激活补体级联参与先天免疫系统以及血管生成和血栓形成[3]。
CRP水平通常可以为AS患者的、治疗和监测提供有用的信息。研究指出,有证据表明CRP与低密度脂蛋白结合并存在于AS斑块中,但不存在于健康的血管壁中。在AS的早期阶段即可检测到CRP,并在疾病进展过程中不断积累。
目前,CRP被认为是未来的,能够独立预测普通人群全因死亡和心血管死亡的风险。
2.IL-6
IL-6是一种多效性细胞因子,参与先天和后天免疫系统,调节急性期反应和慢性炎症。通过测定患者血液样本中IL-6水平发现,冠心病组血液中IL-6水平高于健康组,且与病情越严重程度呈正相关。高脂饮食以及、等疾病是导致AS斑块形成的高危因素。研究发现,IL-6基因缺陷可增加上述高危因素诱发AS斑块形成的风险,IL-6可作为预测AS斑块形成的潜在标志物[3]。
3.黏附分子
黏附分子是介导细胞-细胞或细胞-细胞外基质接触和黏附的一类蛋白质分子。它们通过介导与相应配体的相互作用,参与细胞识别、激活、信号转导、增殖、分化和转移,还介导组织炎症、免疫反应,参与和调节血栓形成,在AS斑块的形成中起重要作用。与AS相关的黏附分子有选择素家族、免疫球蛋白超家族(IgSF)和整合素家族[3]。
(1)选择素家族
选择素家族主要有3种类型:内皮选择素(e-选择素)、血小板选择素(p-选择素)和白细胞选择素(I-选择素)。临床研究发现,血小板选择素(p-选择素)表达水平与AS病变及斑块的程度呈正相关。
(2)疫球蛋白超家族(IgSF)
IgSF有3种类型:即ICAM-1、VCAM-1和血小板内皮细胞黏附分子-1(PECAM-1)。VCAM-1和ICAM-1的高表达促进巨噬细胞增殖,导致大量巨噬细胞在斑块中积聚,从而增加斑块的不稳定性[3]。在AS斑块中,VCAM-1和ICAM-1的高表达促进血管新生,细胞间黏附分子-1表达于AS病变的早期,而VCAM-1可能表达于AS病变的晚期阶段[3]。
(3)整合素家族
1亚家族、 2亚家族和 3亚家族是整合素家族的主要类型。从最早的炎症诱导到晚期纤维化斑块的发生、发展,都可有整合素的参与[3]。
4.基质金属蛋白酶(MMPs)
MMPs是由多种细胞分泌的蛋白质,基质金属蛋白酶介导了稳定AS病变向不稳定表型发展的过程。MMP-9和MMP-2是与AS斑块稳定性密切相关的MMP家族成员[3]。
MMP-9与AS斑块发生呈正相关。动物实验结果显示,在AS动物模型中,MMP-9在动脉及外周血管中的表达水平显著升高,且升高水平与AS病变程度呈正相关[3]。
MMP-2是血管重构的独立危险因子,当血管内皮细胞受损时,单核/巨噬细胞和内皮细胞分泌MMP-2促进细胞外基质降解,促进斑块形成后血管平滑肌细胞(VSMCs)的增殖和迁移。在AS的早期,MMP-2的活性可降解内皮细胞的基底膜,降低内皮细胞的防御能力,促进低密度脂蛋白(LDL)向内膜转移。小鼠实验结果显示,MMP-2缺乏可减少载脂蛋白e(apoE),促进小鼠AS斑块形成[3]。
(二)糖尿病和炎症互相作用共同促进AS的发生发展
糖尿病患者及胰岛素抵抗通过多种途径激活炎症通路,炎性因子可以进一步损伤胰岛 细胞功能,引起胰岛素抵抗的进展,最终共同促进AS的发生发展(图2)。因此,多靶点改善炎症状态对于糖尿病相关的AS治疗十分重要[4]。

图2. 糖尿病和炎症互相作用共同促进动脉粥样硬化发生发展
(三)降糖界的 新星
1902年肠促胰素被发现能促进胰岛素分泌,胰高血糖素样肽-1(GLP-1)是肠促胰素的重要成员之一。GLP-1分泌入血形成活化的GLP-1,能结合并激活胰高血糖素样肽-1受体(GLP-1R)经环磷酸腺苷(cAMP)依赖的蛋白激酶A(PKA)信号通路,从而调节胰岛素和胰高血糖素分泌,发挥控制血糖的作用。当血糖水平升高时,GLP-1促进胰岛素分泌的同时会抑制胰高血糖素的分泌,从而帮助降水平。但是,当血糖水平下降或趋于正常时,GLP-1会减弱甚至中止促进胰岛素分泌的作用。这意味着,即使血糖水平已经降低,GLP-1也不会进一步促使胰岛素分泌,以防止血糖水平过低[5]。
司美格鲁肽是一种新型胰高糖素样肽-1受体激动剂(GLP-1RA)制剂,可与GLP-1R结合发挥与GLP-1相似的降糖效应。其能刺激葡萄糖依赖的胰岛素分泌并减少胰高血糖素分泌、促进胃排空和降低食欲,最终降低2型糖尿病(T2DM)患者糖化血红蛋白(HbA1c)。另外,司美格鲁肽还一定程度上起到降脂、降压、减重及保护心脑血管的作用。
对GLP-1RA开展的心血管结局研究(CVOT)等表明,GLP-1RA在治疗T2DM患者时,可以显著降低心血管疾病(CVD)的发生风险和死亡风险,显示出对心血管系统良好的保护作用。《中国2型糖尿病防治(2020年版)》指出,伴ASCVD或其高危因素的T2DM患者使用GLP-1RA可使心血管死亡、非致死性、非致死性卒中复合事件风险显著降低[2]。
(四)司美格鲁肽 通过抑制炎性因子的表达降低ASCVD的发生风险
1.司美格鲁肽通过抑制炎症因子来减少炎症反应
T2DM患者常伴有慢性、低度的全身性炎症,可以通过检测循环炎症标志物来确定。高血糖水平和与促炎细胞因子的产生有关,这表明T2DM、炎症和AS心血管疾病之间存在机制联系。
Mosenzon等学者对T2DM患者高敏C-反应蛋白(hsCRP)是否与血糖控制和体重变化有关进行了研究。一项事后分析纳入了SUSTAIN和PIONEER两个随机临床试验的患者数据,旨在探讨司美格鲁肽治疗组与对照组在hsCRP水平上的差异[6]。结果显示,与基线相比,使用司美格鲁肽治疗的患者在治疗结束时hsCRP水平有所降低。这种降低的程度与患者基线hsCRP水平有关,即基线hsCRP水平越高,降低的程度越大[6](表1)。
表1. 司美格鲁肽显著降低T2DM患者hs-CRP水平

此外,研究还发现改变HbA1c和体重可能是司美格鲁肽对hsCRP水平产生影响的中间因素。这意味着,司美格鲁肽通过改善血糖控制和减轻体重来降低hsCRP水平[6]。
总的来说,这项研究结果表明,使用司美格鲁肽治疗T2DM可以降低患者体内hsCRP水平,从而可能对炎症状态和产生积极的影响。
2.司美格鲁肽可下调介导AS形成的炎性因子相关基因
Rakipovski等学者为了探究司美格鲁肽对AS的影响以及其作用机制中是否包括炎症途径,使用了ApoE-/-和LDLr-/-小鼠作为AS模型进行了一项观察研究实验[7]。
通过给予ApoE-/-和LDLr-/-小鼠不同剂量的司美格鲁肽进行观察,结果显示,在ApoE-/-小鼠中,司美格鲁肽给药后可以显著减少小鼠的动脉斑块形成;在LDLr-/-小鼠中,司美格鲁肽给药后可以显著减少斑块面积[7]。此外,司美格鲁肽给药后还可以降低小鼠的体重[7]。
进一步的分析显示,司美格鲁肽的抗动脉斑块形成作用与其降低水平无关。在LDLr-/-小鼠中,司美格鲁肽给药后对总胆固醇水平无显著影响,但可以降低甘油三酯水平。在ApoE-/-小鼠中,司美格鲁肽给药后则会略微增加总胆固醇水平[7]。
此外,研究人员进行了基因表达分析发现,司美格鲁肽给药后不仅可以影响动脉斑块形成过程中的炎症相关基因,还可以降低血浆中的炎症标志物水平(图3)。 在给予小鼠脂多糖(LPS)刺激后,司美格鲁肽能够显著降低血浆中的炎症因子TNF- 和干扰素(IFN)- 的水平[7]。
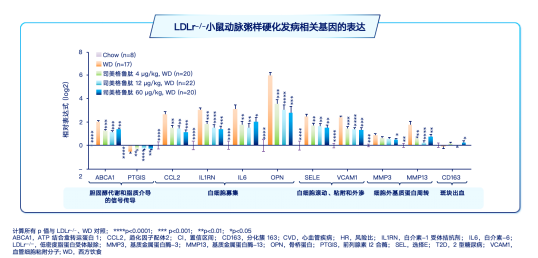
图3. 司美格鲁肽下调介导动脉粥样硬化形成的炎性因子相关基因
这些结果表明司美格鲁肽通过调节炎症途径发挥其对AS的保护作用,为进一步研究司美格鲁肽等GLP-1RA在心血管疾病治疗中的潜在作用提供了重要的依据。
3.司美格鲁肽通过降低巨噬细胞活性来改善炎症
Jensen JK等学者研究了司美格鲁肽在新西兰白兔AS模型中对症的影响。
实验使用了24只雌性SPF新西兰白兔,并对它们进行高胆固醇饮食诱导和腹去内膜化手术,然后随机分为干预组和安慰剂组,在16周前后进行正电子发射断层扫描和计算机断层扫描(PET/CT)成像检测,使用放射性示踪剂铜-64标记的DOTATATE([64Cu]Cu-DOTATATE)评估巨噬细胞活性成像,氟-18标记的氟脱氧葡萄糖([18F]FDG)评估成像细胞代谢。在成像结束后,对兔主动脉进行组织学分析,包括放射自显影和免疫组织化学染色[8](图4)。

图4.
结果显示,司美格鲁肽治疗组的[64Cu]Cu-DOTATATE摄取较安慰剂组更低,这表明司美格鲁肽可以减少动脉炎症的程度。研究还发现,[64Cu]Cu-DOTATATE和[18F]FDG的摄取与动脉壁的巨噬细胞含量呈正相关,这表明这两种示踪剂的摄取水平可以作为评估动脉炎症程度的指标[8](图5)。另外,司美格鲁肽治疗组的白兔体重增长速度较安慰剂组慢,但两组之间的空腹血糖水平没有差异[8]。

图5. 司美格鲁肽可通过降低巨噬细胞活性来改善炎症
总之,这项研究结果表明,司美格鲁肽可以降低动脉炎症的程度,并且动脉炎症的程度与[64Cu]Cu-DOTATATE和[18F]FDG的摄取水平相关[8]。这些发现为进一步研究司美格鲁肽在AS治疗中的潜在作用提供了重要线索。
综上所述,司美格鲁肽不仅可以通过降低血糖、调节血脂和减轻体重来帮助T2DM患者,还具有抗炎和降低总负荷的效果。这意味着,对于T2DM合并冠心病的患者,司美格鲁肽可以延缓冠状动脉粥样硬化的进展,从而改善其预后。
参考文献:
[1]国家心中心.中国心血管健康与疾病报告2021[M].北京:科学出版社.2022.
[2]中华医学会糖尿病学分会.中国2型糖尿病防治指南(2020年版)[J].中华糖尿病杂志,2021,13(4):315-409.
[3]Zhu Y,Xian X,Wang Z,et al.Research Progress on the Relationship between Atherosclerosis and Inflammation[J].Biomolecules,2018,8(3):80-80.
[4]Gerstein HC,Colhoun HM,Dagenais GR,et al.Dula-glutide and cardiovascular outcomes in type 2 diabetes(REWIND):adouble-blind,randomised placebo-con-
trolled trial[J].,2019,394(10193):121-130.
[5]Marso SP,DanielsGH,Brown-FrandsenK,et al.Li-raglutide and Crdiovascular Outcomes in Type 2 Diabetes[J].N Engl J Med,2016,375(4):311-322.
[6]Ofri M,S. M C,Alessandra R D,et al.Impact of semaglutide on high-sensitivity C-reactive protein: exploratory patient-level analyses of SUSTAIN and PIONEER randomized clinical trials[J].Cardiovascular Diabetology,2022,21(1):172-172.
[7]Rakipovski G,Rolin B,N hr J,et al.The GLP-1 Analogs Liraglutide and Semaglutide Reduce Atherosclerosis in ApoE / and LDLr / Mice by a Mechanism That Includes Inflammatory Pathways[J].JACC:Basic to Translational Science,2018,3(6):844-857.
[8]K J J,Tina B,E C G,et al.Semaglutide reduces vascular inflammation investigated by PET in a rabbit model of advanced atherosclerosis.[J].Atherosclerosis,2022,352:88-95.
作者简介:

高超
深圳市龙岗区中医院 心内科主治医师 硕士研究生,主治医师
主要从事心血管相关疾病的临床诊治
发表SCI及中文核心期刊10余篇
主编参编写著作5部,参与省/区级课题2个
深圳市中医药学会介入心脏病专业委员会委员
深圳市中医药学会心血管专业委员会委员
深圳市中西医结合学会心血管介入委员会委员
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 全球首个百亿级人类基因组基础模型Genos发布! (2025-10-23)
- CRISPR编辑肝类器官破解凝血因子VII缺乏症难题!Haematologica开辟罕见出血病自体治疗新范式 (2025-10-23)
- 《细胞》:肿瘤被“坑”杀!哈佛大学团队发现全新抗癌结构,杀伤性T细胞可在里面直接杀死癌细胞 (2025-10-23)
- Nature子刊:鲁明/钦伦秀团队发现肿瘤相关巨噬细胞促进肝癌转移的新机制 (2025-10-23)
- 《科学》:科学家发现酸中毒是肿瘤适应代谢压力的关键! (2025-10-23)
- 第三轮通知 | 2025年CSEV第九届细胞外囊泡大会倒计时2天! (2025-10-22)
- Adv Sci/eLife:中山大学高国全/杨霞/齐炜炜团队从代谢角度揭示阿尔兹海默症认知功能障碍的新调控分子 (2025-10-22)
- 《自然·代谢》:巨噬细胞竟是个“醋坛子”!中科院/复旦团队首次发现,肝癌用乳酸诱导巨噬细胞合成乙酸,促进自身转移 (2025-10-22)
- 上海德达心血管医院成功举办《胸痛的识别和心脏大血管疾病的规范治疗》研讨会 (2025-10-22)
- 第八届(2025)中国医疗器械创新创业大赛人工智能与医用机器人类别赛圆满落幕 (2025-10-21)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















