Nat Cell Biol |
 |

随后,发现VAMP2的近膜区域通过静电相互作用与 -syn的羧基端区域结合,并介导包含多组分的凝聚体动态组装,进而保护 -syn免于形成致病淀粉样纤维聚集体。本研究不仅揭示了 -syn在生理状态下通过相分离执行功能的分子机制,还揭示了VAMP2的全新功能,即通过在神经突触前体中形成多组分凝聚相,维持 -syn的正常功能并防止其病理性聚集;暗示该机制的失效可能与的发病密切相关。
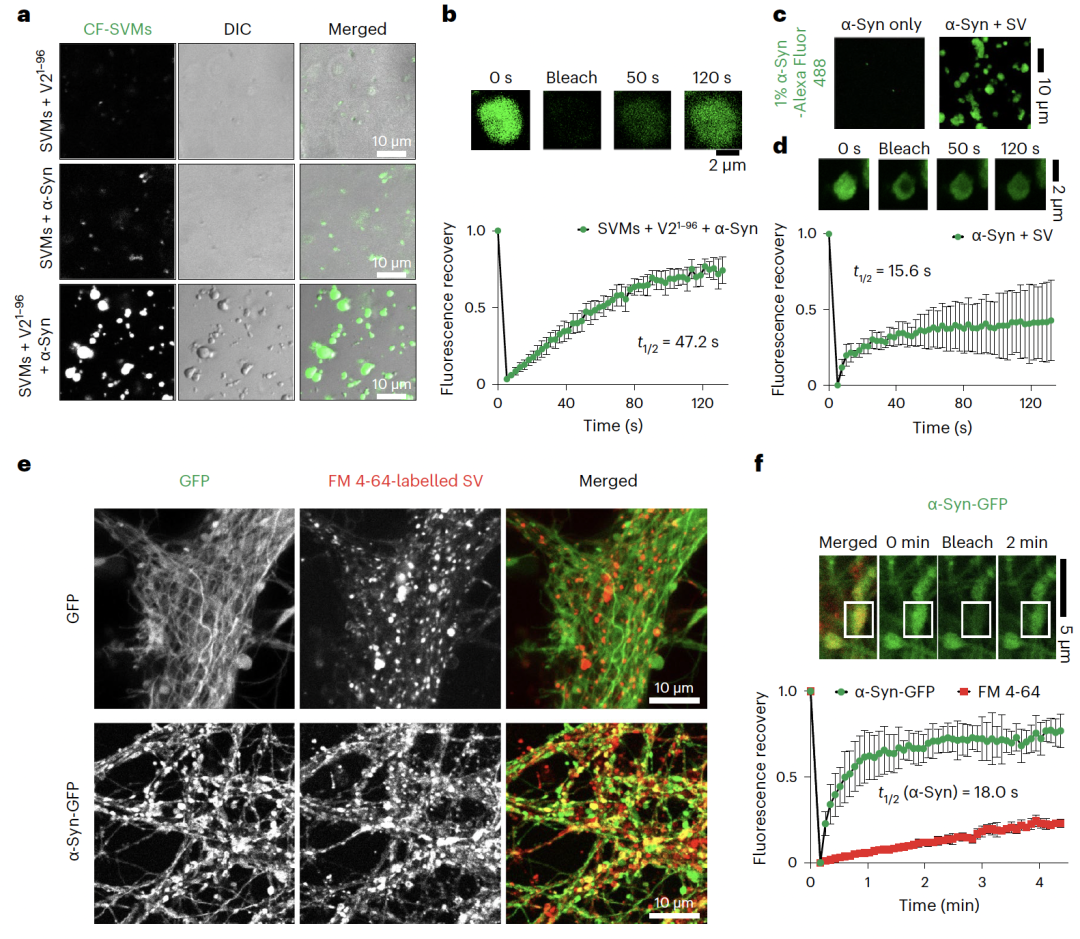
图 1. -Syn、VAMP2和SVs的多组分液-液相分离(Credit:Nature Cell Biology)
李丹课题组长期聚焦神经退行性疾病关键病理蛋白相分离及聚集的动态调控 机制以及化学干预研究。前期研究系统阐释了不同类型分子(如:分子伴侣,化学小分子,聚糖,病毒等)识别及调控病理蛋白(如:帕金森病的 -syn,渐冻人症FUS, TDP-43等)相分离及聚集的机制(;;)【2-4】,并发展小分子探针特异性识别 -syn聚集体用与疾病临床检测【5】。
李丹课题组早在2017年就开始与合作者进行本项目的研究,从多组分( -syn、VAMP2、SV)的液-液共相分离现象出发,逐步阐释VAMP2及SV是如何通过调控 -syn的动态相分离来促进其执行生理功能。研究过程中,不断有文章报道发现 -syn能够通过液-液相分离促进局部成核聚集【6】。因此, -Syn相分离目前被认为与其病理毒性密切相关。此外,SV在突触前膜附近也被发现可以与突触相关蛋白形成凝聚体【7, 8】,构成突触前的SV集群,作为神经信号快速释放的储备池。然而, -Syn相分离是否在其正常生理功能中扮演角色,SV在其中又起到什么作用一直是领域中悬而未决的关键科学问题。在本工作中,研究者观察到 -syn除了能够自身发生相分离外,还能够与VAMP2以及SV发生多组分共相分离。进一步,通过液态核磁技术以及交联质谱等方法表征了 -syn与VAMP2相互作用的结构基础。通过设计不同的突变体,验证了 -syn的负电羧基端区域与VAMP2的正电近膜区域是多组分共相分离凝聚体形成的关键互作区域。随后,发现破坏介导 -syn和VAMP2共凝聚的互作能够显著减少SV的集群,并降低神经细胞中SNARE复合体的形成及神经递质的运输效率。最后,通过体外硫黄素T动力学实验和细胞毒性实验证明VAMP2与 -syn的互作对于抑制 -syn淀粉样病理聚集及其病理毒性具有关键调控作用。
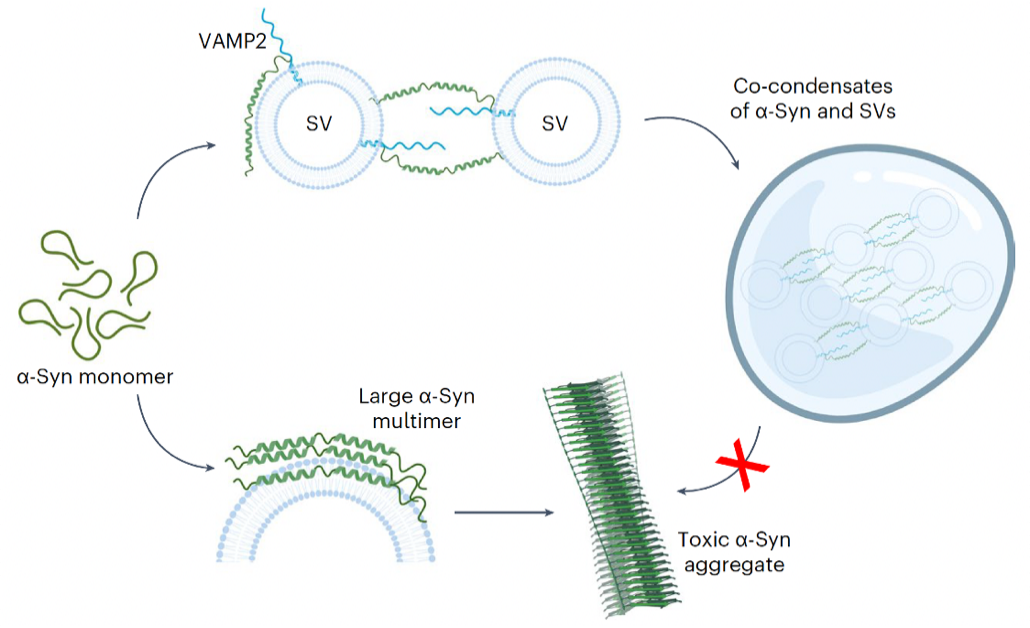
图 2. VAMP2调节 -Syn相分离和功能的分子机制示意图(Credit:Nature Cell Biology)
值得一提的是, 英国剑桥大学的Janin Lautenschl ger课题组同期独立发现了与本研究类似的VAMP2调节 -syn相分离的现象【9】,两个独立工作相互验证支持,并以背靠背的形式同一天在线发表于Nature Cell Biology上(图3)。

图 3.背靠背的另一篇类似工作
医药网新闻
- 相关报道
-
- 致癌代谢物2HG竟是肥胖“隐形推手”?!Nat Metabol 最新研究中科学家揭秘肥胖发生新机制 (2025-08-05)
- Sci Adv:科学家有望重新训练中性粒细胞来靶向治疗乳腺癌 (2025-08-05)
- 特洛伊木马:复旦大学最新论文登上Cell子刊封面 (2025-08-05)
- TN:南京医科大学团队发现,长期运动可通过改善脑膜淋巴管结构和引流功能,减轻AD病理,并改善小鼠认知功能 (2025-08-05)
- 柳叶刀:塑料危机——对人类从摇篮到坟墓的健康威胁 (2025-08-05)
- Nature子刊:中山大学林浩添/陈崴团队开发AI模型,利用视网膜图像无创诊断慢性肾病 (2025-08-05)
- 四部分脱手!医疗科普不是“流量生意” (2025-08-05)
- 3000余人追踪35年!JAMA子刊:心血管病发前12年身体活动已下滑,发病后运动量暴跌78% (2025-08-05)
- David Baker最新论文:像拼乐高一样设计蛋白,可编程蛋白组装,解锁纳米材料新纪元 (2025-08-05)
- Cancer Cell:肺腺癌的多组学分析——科学家成功揭示跨种族和暴露背景下的致癌机制 (2025-08-05)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















