《自然》:乳酸竟成癌细胞“保护伞”!中山大学团队发现,乳酸会促进癌细胞修复DNA损伤,帮助癌细胞抵抗放化疗 |
 |
《自然》:乳酸竟成癌细胞“保护伞”!中山大学团队发现,乳酸会促进癌细胞修复DNA损伤,帮助癌细胞抵抗放化疗
来源:奇点糕 2024-07-07 09:59
这项研究再次证实乳酸化对肿瘤的生存有重要作用,他们也首次发现乳酸化可以促进癌细胞DNA损伤的修复,以及抗癫痫药物司替戊醇有提升放化疗效果的潜力。就在两个多月前,苏州大学周芳芳团队发现,[1]。
除此之外,我们之前还报道过:[2-4],抑制功能[5],[6]。
还真是无恶不作!
然而,今天中山大学附属第七医院张常华/何裕隆,中山大学孙逸仙纪念医院尹东,以及英国癌症研究院Axel Behrens组成的联合团队,在顶级期刊《自然》上发表一项重磅研究成果,又刷新了我对乳酸的认知[7]。
原来,肿瘤还可以利用乳酸帮自己抵挡的伤害。具体来说,乳酸可以促进修复断裂的DNA,维持癌细胞基因组的稳定,让想通过扰乱癌细胞基因组杀死癌细胞的放化疗失效。
乳酸又罪加一等!
中山大学附属第七医院的陈恒星、中山大学孙逸仙纪念医院的李贇和英国癌症研究院的李华福是论文的共同第一作者。

▲论文首页截图
在研究的一开始,研究人员就想了解是如何应对新辅助化疗带来的DNA损伤的。
他们首先对接受过铂类新辅助化疗(NAC)的胃癌术后标本,进行了蛋白质组学和非靶向代谢组学分析。
在对比对铂类新辅助化疗敏感或耐受样本的蛋白和代谢组数据之后,他们发现合成乳酸的乳酸脱氢酶(LDHA)是耐药肿瘤中上调最高的蛋白质之一,而且乳酸是耐药肿瘤中含量最高的代谢物之一。
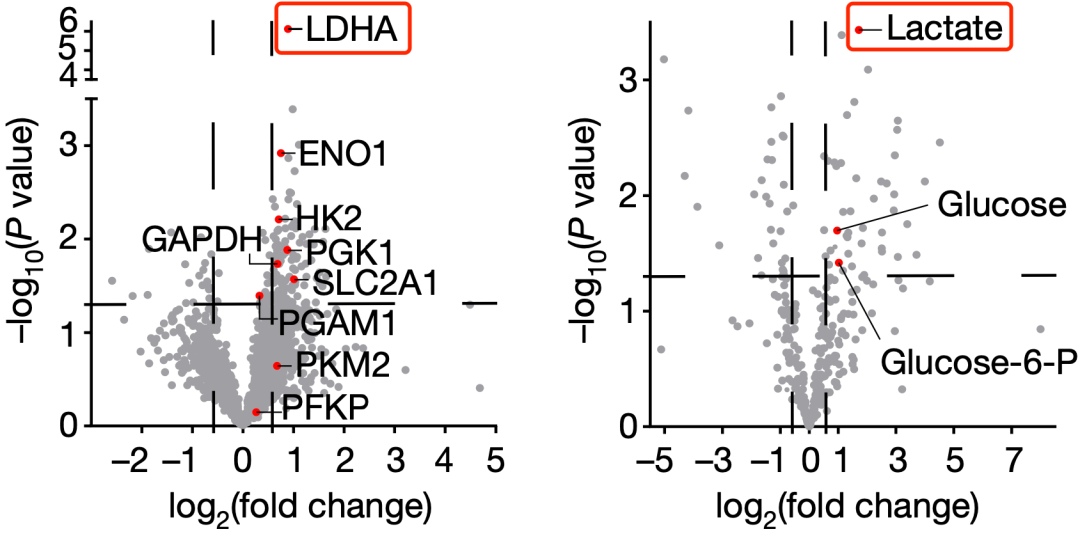
▲乳酸暴露了
很显然,耐药的矛头直指乳酸。
于是,研究人员将对化疗敏感的人胃癌细胞系(MGC803-P)移植到小鼠身上,他们发现单用乳酸盐不会影响肿瘤的生长,但是乳酸盐会削弱顺铂抑制肿瘤生长的效果,并缩短小鼠的存活时间。不过,一旦消耗掉中的乳酸摄取转运体MCT1,乳酸就不会促进顺铂耐药性的产生。
他们又尝试了另一种DNA损伤抗癌疗法 放疗(IR),发现乳酸盐也能增强肿瘤对放疗的抵抗力。
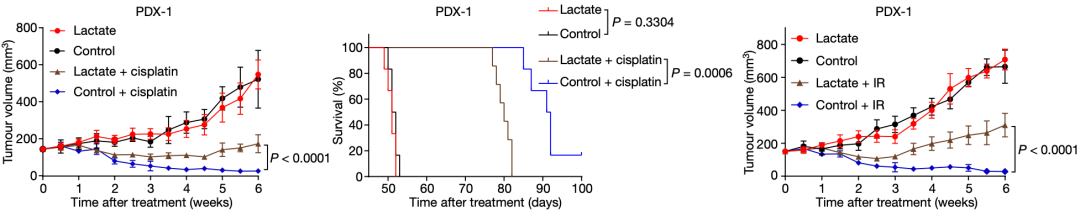
▲乳酸对放化疗的影响
以上的实验现象说明,乳酸、DNA损伤修复和放化疗之间存在密切关系。
那乳酸又是如何影响放化疗带来的DNA损伤呢?
研究结果表明,乳酸显著提高了癌细胞的同源重组(HR)修复效率,但仅轻微提高了癌细胞的非同源末端连接(NHEJ)修复效率。显然,乳酸参与了癌细胞中HR介导的DNA修复,并主要通过这个途径帮助癌细胞保持基因组的稳定性,避免癌细胞的死亡。
在揭示背后的具体分子机制的时候,研究人员想到了乳酸化。
早在2019年,芝加哥大学赵英明团队就首次揭示:[3]。我在前面也提到过,苏州大学周芳芳团队也发现乳酸会以乳酸化的形式导致抑癌蛋白p53失活。
不难看出,乳酸化是肿瘤利用乳酸的一种重要手段。
于是研究人员全面分析了DNA修复与乳酸化的关系,筛选出了赖氨酸乳酸化水平升高的DNA修复相关蛋白,其中的NBS1引起了他们的注意,因为NBS1是MRN复合物(MRE11-RAD50-NBS1)的关键组成部分,而MRN复合物在感知DNA双链断裂和激活DNA修复途径方面发挥着关键作用。
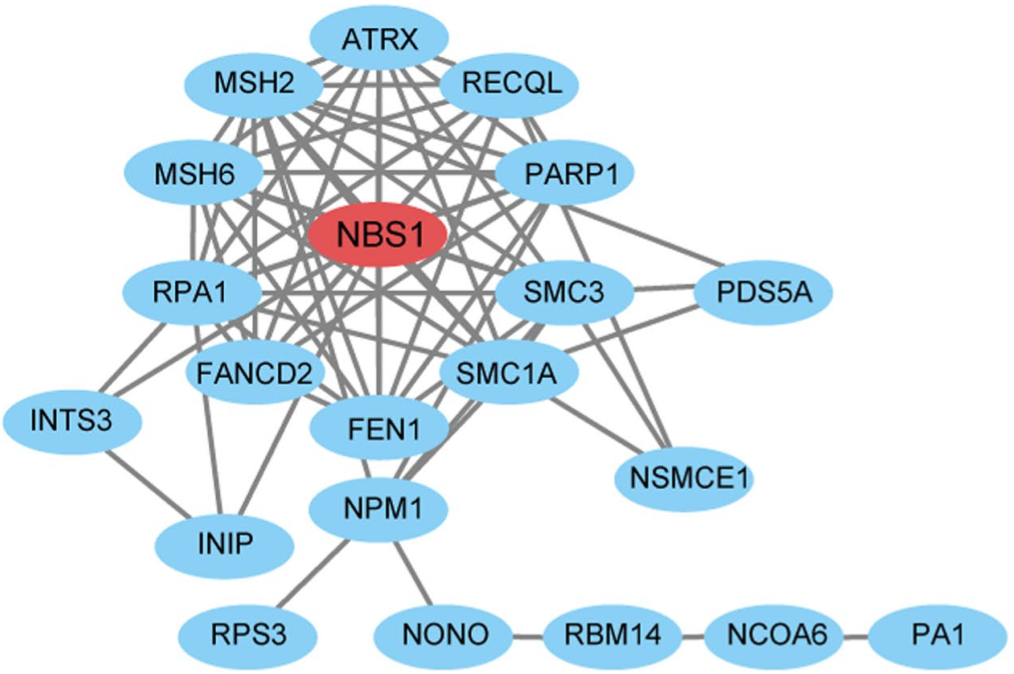
▲NBS1居C位
基于人胃腺癌细胞系的研究表明,只要耗尽NBS1,乳酸就失去了促进癌细胞对顺铂耐受的能力。因此,研究人员重点研究了NBS1的乳酸化。
研究结果显示,NBS1的第388位赖氨酸(K388)是关键所在。当NBS1的K388被乳酸化之后,会促进MRE11-RAD50和NBS1的相互作用,而K388恰好就位于相互作用界面上。
后续研究还发现,NBS1乳酸化不仅促进了MRN复合物的形成,还促进了HR蛋白向DNA断裂位点的聚集。
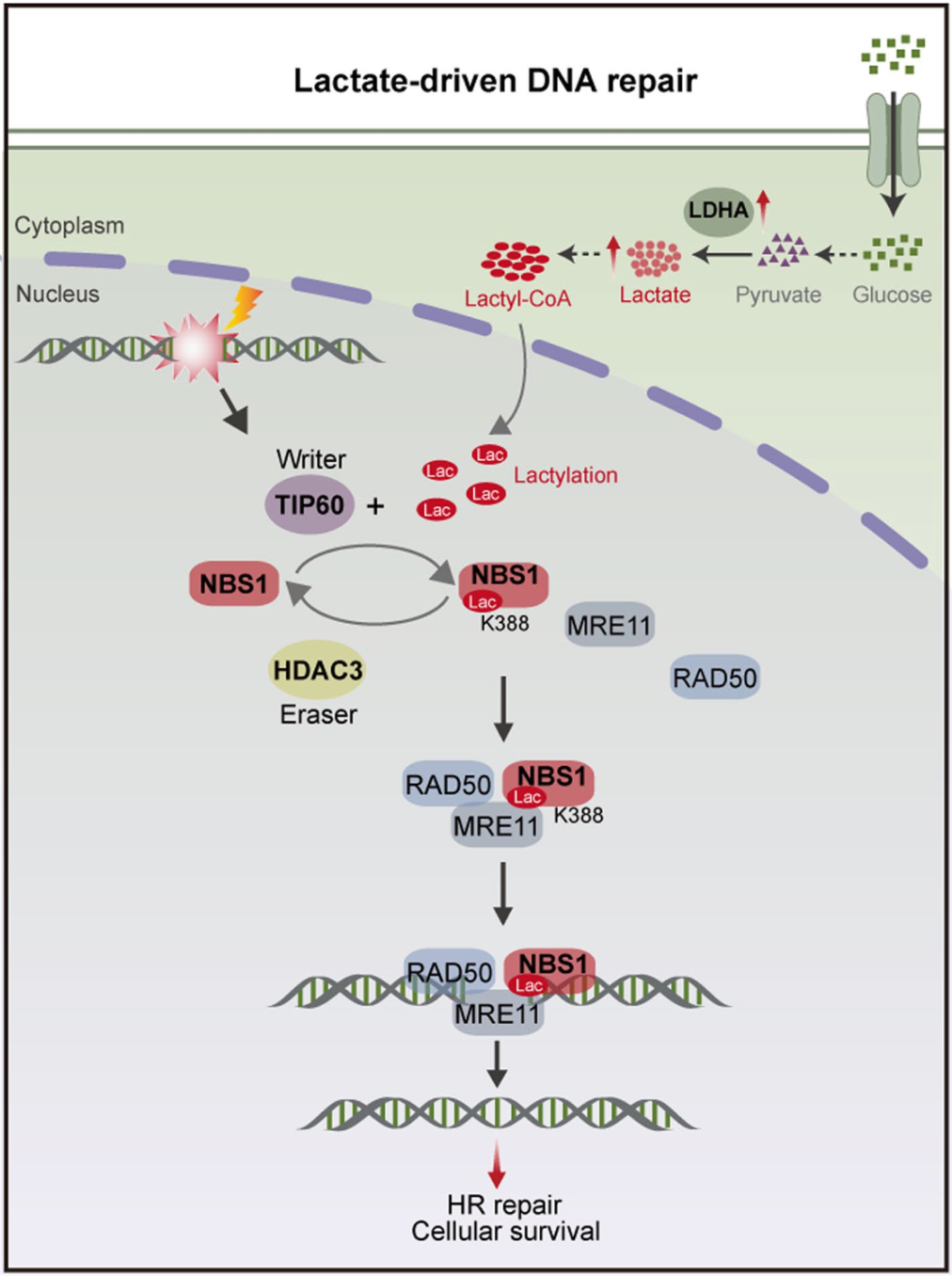
▲乳酸促进癌细胞DNA修复的机制示意图
既然搞清楚了乳酸作恶的方式,研究人员就测试了两种乳酸脱氢酶(LDHA)抑制剂的效果,发现已经获批上市的抗癫痫药物司替戊醇(stiripentol)能显著减少乳酸的产生和NBS1 K388的乳酸化。
在胃癌患者来源的肿瘤类器官(PDO)和人源性组织异种移植(PDX)小鼠模型中,司替戊醇与化疗或放疗联合使用,均有强烈的协同抗癌效果,并延长小鼠的生存时间。
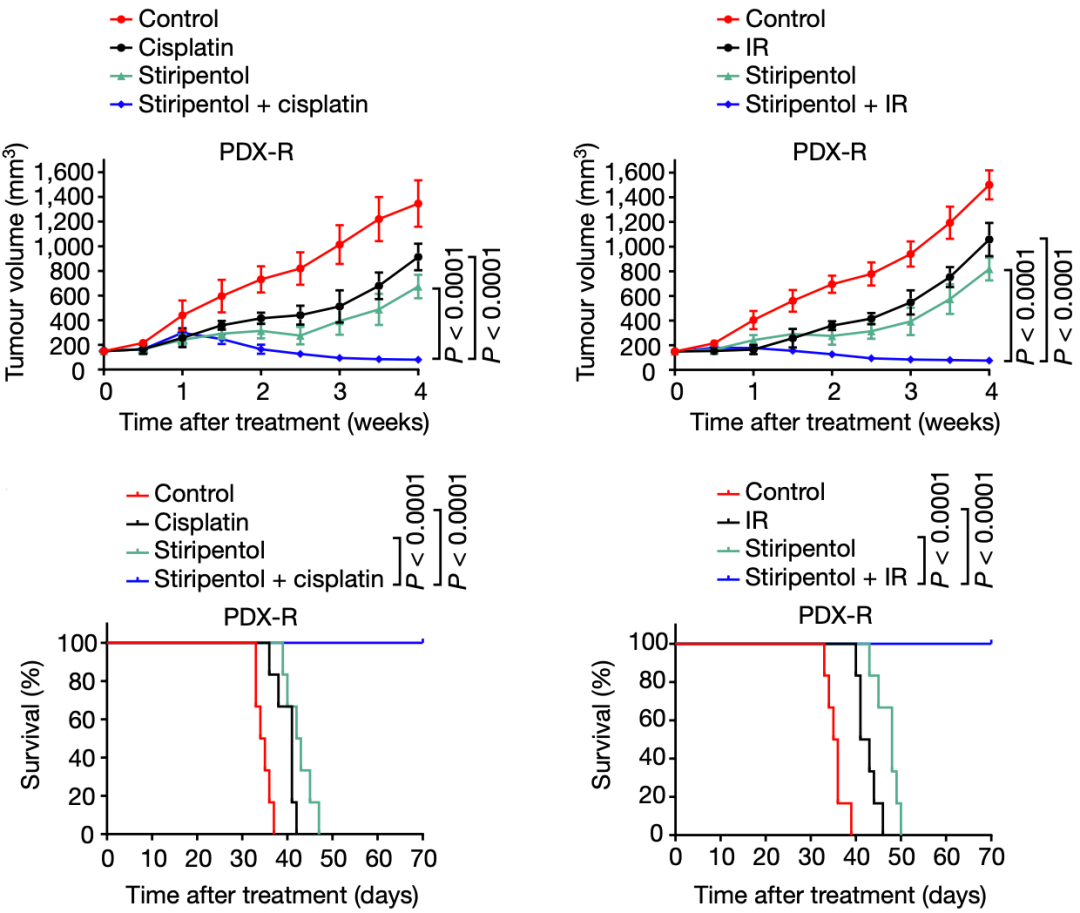
▲司替戊醇能增强放化疗的效果
在研究的最后,研究人员探索了乳酸化与癌症患者预后的关系,他们发现,乳酸脱氢酶的表达和NBS1 K388乳酸化,均与新辅助化疗的临床耐药性相关。NBS1 K388乳酸化水平高或乳酸脱氢酶水平高的患者,总生存率远低于水平低的患者。
总的来说,张常华/何裕隆/尹东/Axel Behrens领衔的这项研究再次证实乳酸化对肿瘤的生存有重要作用,他们也首次发现乳酸化可以促进癌细胞DNA损伤的修复,以及抗癫痫药物司替戊醇有提升放化疗效果的潜力。
据了解,中山大学附属第七医院已经注册了名为 司替戊醇联合免疫靶向化疗用于常规治疗无效的腹膜转移癌患者单臂前瞻性单中心试验 的单臂、II期前瞻性临床研究(注册号:ChicTR2400083649)[8],探讨司替戊醇联合靶向免疫化疗用于化疗联合免疫和进展的腹膜转移癌患者的安全性和有效性,从而为逆转肿瘤耐药和晚期综合治疗提供新的策略。
期待这项临床研究早日取得成功。
参考文献:
[1].Zong et al., Alanyl-tRNA synthetase, AARS1, is a lactate sensor and lactyltransferase that lactylates p53 and contributes to tumorigenesis. Cell. 2024. doi:10.1016/j.cell.2024.04.002
[2].Bohn T, Rapp S, Luther N, et al. Tumor immunoevasion via acidosis-dependent induction of regulatory tumor-associated macrophages. Nat Immunol. 2018;19(12):1319-1329. doi:10.1038/s41590-018-0226-8
[3].Zhang D, Tang Z, Huang H, et al. Metabolic regulation of gene expression by histone lactylation. Nature. 2019;574(7779):575-580. doi:10.1038/s41586-019-1678-1
[4].Qian Y, Galan-Cobo A, Guijarro I, et al. MCT4-dependent lactate secretion suppresses antitumor immunity in LKB1-deficient lung adenocarcinoma. Cancer Cell. 2023;41(7):1363-1380.e7. doi:10.1016/j.ccell.2023.05.015
[5].Watson MJ, Vignali PDA, Mullett SJ, et al. Metabolic support of tumour-infiltrating regulatory T cells by lactic acid. Nature. 2021;591(7851):645-651. doi:10.1038/s41586-020-03045-2
[6].Kumagai S, Koyama S, Itahashi K, et al. Lactic acid promotes PD-1 expression in regulatory T cells in highly glycolytic tumor microenvironments. Cancer Cell. 2022;40(2):201-218.e9. doi:10.1016/j.ccell.2022.01.001
[7].Chen, H., Li, Y., Li, H. et al. NBS1 lactylation is required for efficient DNA repair and chemotherapy resistance. Nature. 2024. doi:10.1038/s41586-024-07620-9
[8].https://www.chictr.org.cn/showproj.html?proj=221035
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- NEJM:人工视网膜,帮助老年性黄斑变性患者恢复视力 (2025-10-25)
- 华中师范大学最新Cell子刊论文:开发治疗白血病的多肽类药物 (2025-10-25)
- 《科学》:膳食脂肪重塑昼夜节律!加州大学科学家发现,饮食中不饱和脂肪酸比例会影响昼夜节律,是人体生物钟与季节匹配与否的关键 (2025-10-25)
- 河南中州实验室发表Nature Metabolism论文:揭开大脑髓鞘再生修复的关键 (2025-10-25)
- Nature Medicine:为疲惫的心脏“重启引擎”——基因疗法AB-1002能否逆转心力衰竭的宿命? (2025-10-25)
- 槲皮素哪个牌子好?槲皮素品牌前十名:肺结节该怎么选? (2025-10-25)
- 西安多欧信息咨询 :深耕医疗赛道,以全案服务赋能行业创新 (2025-10-24)
- 便秘药物最新推荐 (2025-10-24)
- 叶酸什么牌子口碑最好 (2025-10-24)
- 加科思药业在AACR-NCI-EORTC国际大会公布泛KRAS抑制剂(JAB-23E73)临床前数据 (2025-10-24)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















