《自然》:生酮背刺癌王!科学家首次发现,生酮饮食迫使胰腺癌改变代谢方式、暴露致命破绽 |
 |
来源:网络 2024-08-26 11:44
在生酮饮食的同时,用药物阻断胰腺癌的翻译调控通路,就能置胰腺癌于死地?我们之前也成报道过生酮饮食的多种抗癌方式。
例如,[1];[2];以及[3],等等。
虽然阅 机制 无数,但是今天这个抗癌思路,还是让我大呼 过瘾 。
今日,由加州大学旧金山分校Davide Ruggero领衔的研究团队(杨浩君是论文的第一作者),在顶级期刊《自然》上发表一项重磅研究成果。
他们发现,生酮饮食其实也拿没办法,从正常饮食切换到生酮饮食,胰腺癌照样生长,完全不受影响。不过,他们注意到,胰腺癌为了适应饮食变化,也付出了代价:它通过翻译调控的方式,将自身的代谢方式切换到可以将酮体作为能源的模式。
胰腺癌的这一转变,一下子让Ruggero团队看到了破绽:在生酮饮食的同时,用药物阻断胰腺癌的翻译调控通路,就能置胰腺癌于死地。
如此看来,对付癌王,懂点儿兵法还是有好处的。

▲论文首页截图
说起来,Ruggero团队在一开始的研究计划并不是生酮饮食和胰腺癌,而是禁食是如何改变代谢方式,进而有益健康的。
在让小鼠禁食24小时之后,他们发现,真核翻译起始因子4E(eIF4E)的209位丝氨酸磷酸化水平增加,这种磷酸化后的eIF4E(P-eIF4E)处于激活状态。而且,eIF4E唯一已知的激酶MNK,在禁食期间活性也增加。
不过,在小鼠开始吃饭之后,P-eIF4E的水平就会降低。显然,eIF4E的活性受进食状态的影响。
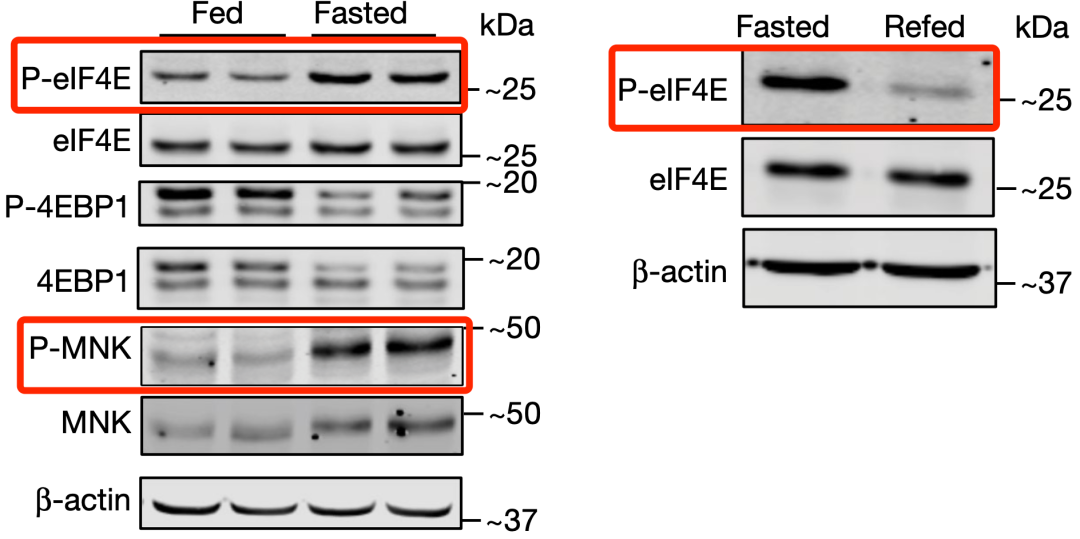
▲eIF4E的活性受进食状态的影响
从转录组的水平来看,在禁食期间,有615个转录本的翻译效率显著上调。
这些基因主要参与脂质代谢,其中又以酮体的产生居首位。例如,酮体生成的限速酶Hmgcs2,以及肝脏脂质代谢/酮体生成的主调控因子PPAR 等。
显然,从进食到禁食的转变改变了肝脏的蛋白翻译格局,特别是增加了参与脂质代谢和酮体生成的基因的翻译。
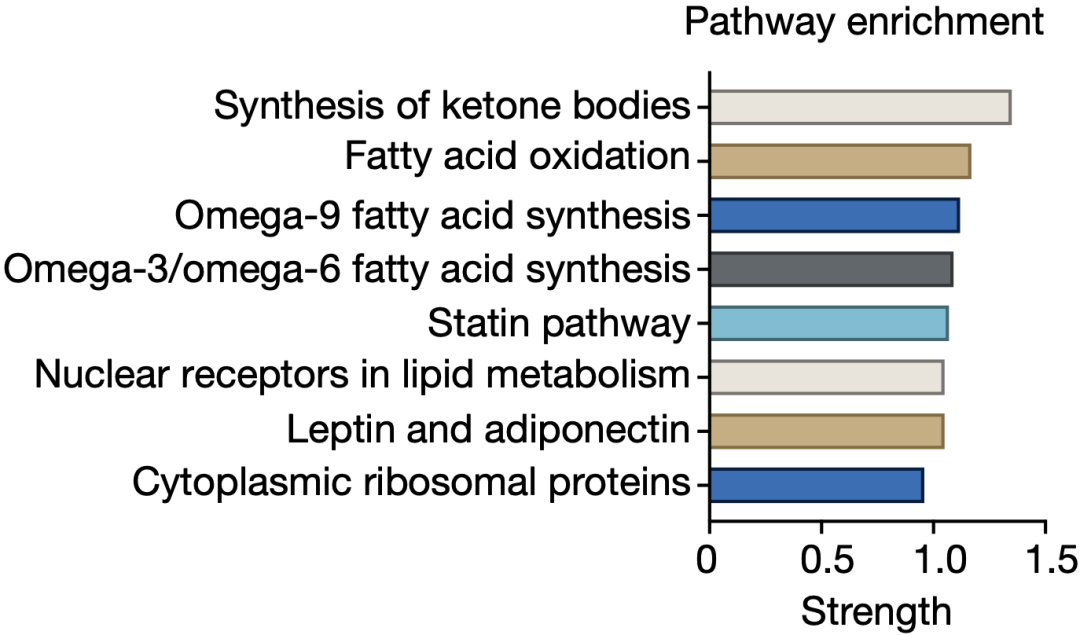
▲酮体生成排第一
那么以上的基因翻译变化是由禁食诱导的P-eIF4E调控的吗?
答案是肯定的。
定点突变eIF4E第209位丝氨酸(eIF4ES209A)之后,与野生型小鼠相比,禁食24小时的突变鼠产生的 -羟丁酸(BHB,血液中最丰富的酮体)显著减少。
而且,之前在禁食时翻译上调的615个基因中,有445个基因在突变鼠的肝脏中显著下调,其中就包括Ppara和Hmgcs2。
后续研究还证实,P-eIF4E直接与mRNA的特定区域相互作用,进而完成对蛋白翻译的调节。
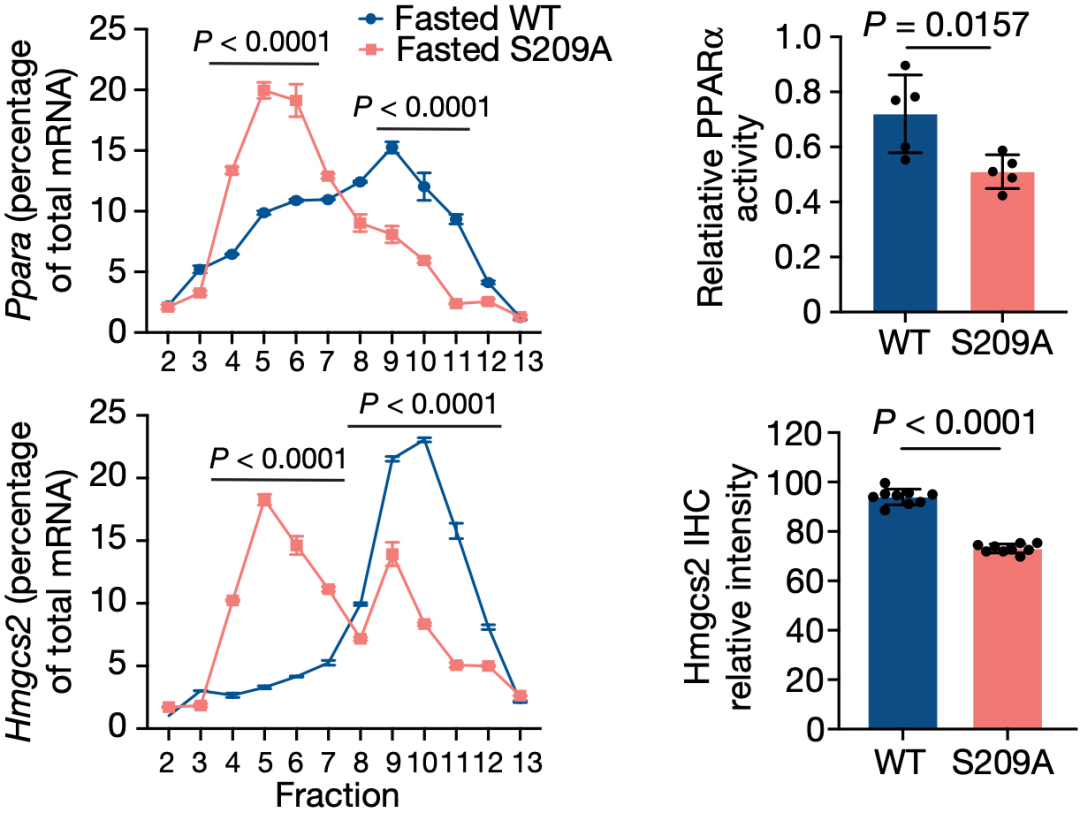
▲P-eIF4E确实在调控特定基因的翻译
在上面的研究中,我们已经知道,禁食激活了MNK-eIF4E通路,导致eIF4E磷酸化被激活,进而改变翻译网络,促进酮体的产生。
那么,接下来的问题是:禁食又是如何激活MNK-eIF4E通路的呢?
Ruggero团队注意到,之前已经有研究证实,禁食的主要特征之一是血液中游离脂肪酸(例如棕榈酸、油酸和亚油酸)水平增加,而且这些脂肪酸也可以作为信号分子发挥作用。
于是,脂肪酸就成了他们的突破口。
在用上述三种脂肪酸处理肝细胞之后,他们发现这些脂肪酸都能激活MNK-eIF4E通路,尤其是亚油酸。然而,这些脂肪酸并不是直接作用于MNK,而是直接与MNK上游的AMPK相互作用,并激活AMPK,继而激活MNK-eIF4E通路。
简单来说,就是禁食会增加脂肪酸水平,游离的脂肪酸与AMPK互作并激活AMPK,AMPK随后又磷酸化MNK,被磷酸化激活的MNK再磷酸化eIF4E,促进P-eIF4E的形成,最终调控蛋白的翻译网络,提升酮体水平。
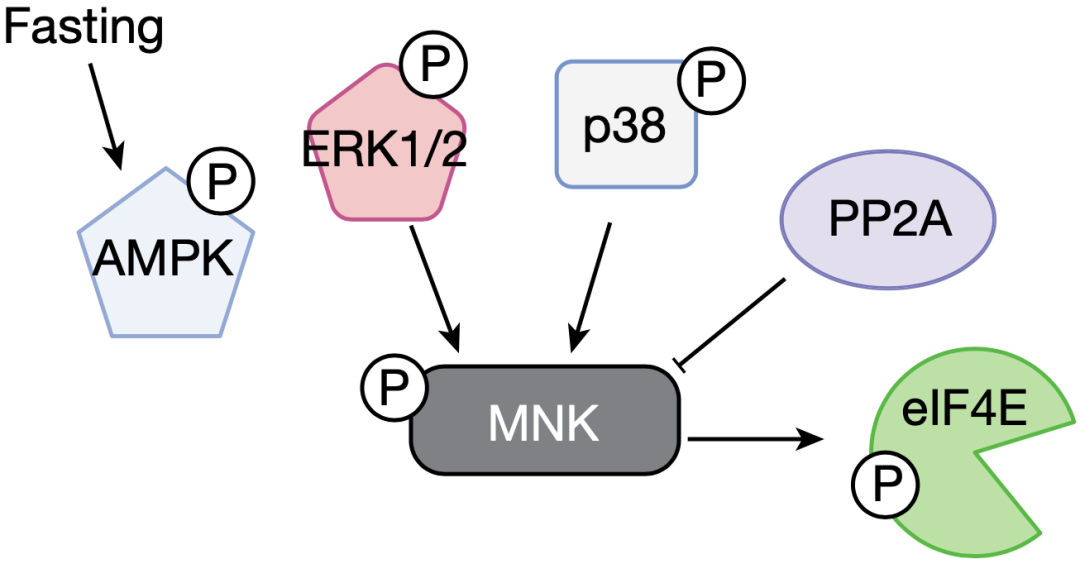
▲通路探秘
考虑到生酮饮食也会增加酮体的产生,Ruggero团队想知道背后是不是有类似的机制。
他们发现,在将小鼠的饮食换成生酮饮食之后,肝脏中AMPK磷酸化水平和活性增加,P-eIF4E的水平也显著增加。而用药物抑制AMPK活性,则会降低MNK和eIF4E的磷酸化水平。
不难看出,P-eIF4E也调控着生酮饮食的酮体产生。
这个时候,一种全新的抗癌思路就浮现在Ruggero和他同事的脑海中:有些癌细胞为了生存也会将酮体作为能量来源,如果阻断上面发现的通路,是不是就可以抗癌了。
他们先用两种胰腺癌细胞系检验了上述假设。
研究结果显示,单独的生酮饮食或者MNK抑制剂(eFT508),都不能抑制肿瘤的生长;而将生酮饮食与MNK抑制剂联合使用,则可以显著抑制肿瘤的生长。
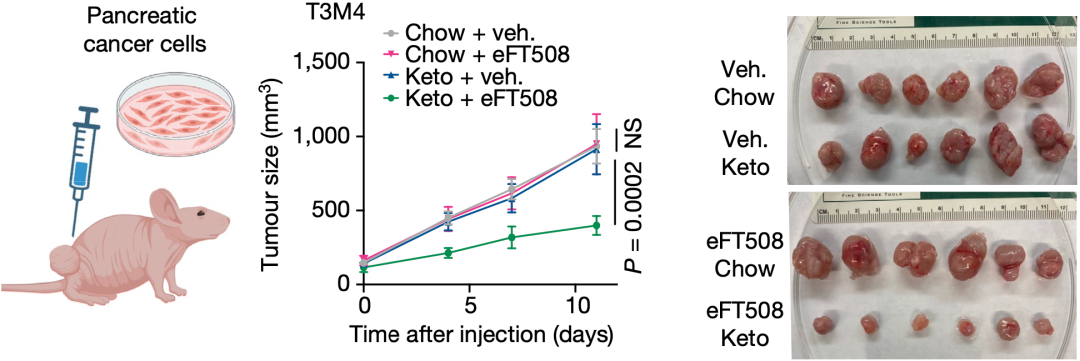
▲生酮饮食(Keto)联合MNK抑制剂(eFT508),有显著抗癌效果
究其背后原因,原来是生酮饮食重塑了癌细胞的翻译组,例如癌细胞中MNK-eIF4E通路被激活,生产酮体,在能量不足的情况下,癌细胞就利用酮体供能。
而MNK抑制剂(eFT508)恰好阻断了这一过程,让癌细胞在生酮饮食的情况下真的无 粮 可吃。
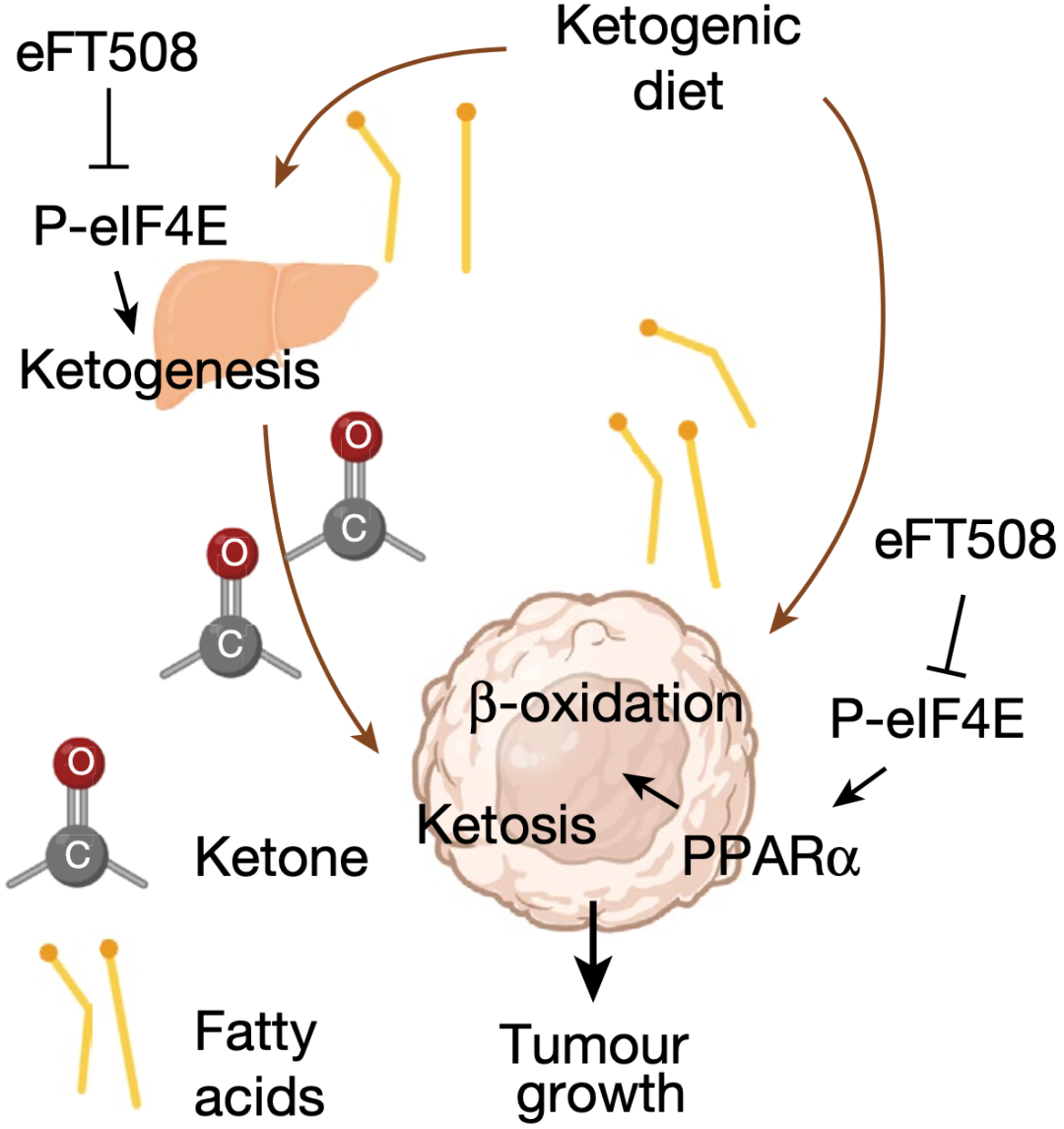
▲机制示意图
总的来说,Davide Ruggero团队的这项研究表明,在禁食/生酮饮食条件下,游离脂肪酸会激活AMPK-MNK-eIF4E通路,进而调节细胞特定基因的翻译水平,重塑细胞的能量代谢方式。据了解,这也是科学家首次发现P-eIF4E参与了翻译调控。
对于胰腺癌而言,在生酮饮食的条件下,癌细胞会通过翻译调控的方式重置自己的代谢途径,以适应生酮饮食带来的能量供应不足问题。这不仅揭示生酮饮食对胰腺癌无效的机制,也为生酮饮食联合药物治疗胰腺癌提供了新思路。
据了解,MNK抑制剂(eFT508)已经处于临床研究阶段。值得注意的是,除了抗癌之外,Ruggero团队2021年的一项研究成果还显示,eFT508还有治疗肥胖症的潜力[5]。
期待Ruggero团队后续的研究成果。
参考文献:
[1].Hopkins BD, Pauli C, Du X, et al. Suppression of insulin feedback enhances the efficacy of PI3K inhibitors [published correction appears in Nature. 2018 Nov;563(7731):E24. doi: 10.1038/s41586-018-0506-3]. Nature. 2018;560(7719):499-503. doi:10.1038/s41586-018-0343-4
[2].Dai X, Bu X, Gao Y, et al. Energy status dictates PD-L1 protein abundance and anti-tumor immunity to enable checkpoint blockade. Mol Cell. 2021;81(11):2317-2331.e6. doi:10.1016/j.molcel.2021.03.037
[3].Dmitrieva-Posocco O, Wong AC, Lundgren P, et al. -Hydroxybutyrate suppresses colorectal cancer. Nature. 2022;605(7908):160-165. doi:10.1038/s41586-022-04649-6
[4].Yang, H., Zingaro, V.A., Lincoff, J. et al. Remodelling of the translatome controls diet and its impact on tumorigenesis. Nature. 2024. doi:10.1038/s41586-024-07781-7
[5].Conn CS, Yang H, Tom HJ, et al. The major cap-binding protein eIF4E regulates lipid homeostasis and diet-induced obesity. Nat Metab. 2021;3(2):244-257. doi:10.1038/s42255-021-00349-z
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- NEJM:人工视网膜,帮助老年性黄斑变性患者恢复视力 (2025-10-25)
- 华中师范大学最新Cell子刊论文:开发治疗白血病的多肽类药物 (2025-10-25)
- 《科学》:膳食脂肪重塑昼夜节律!加州大学科学家发现,饮食中不饱和脂肪酸比例会影响昼夜节律,是人体生物钟与季节匹配与否的关键 (2025-10-25)
- 河南中州实验室发表Nature Metabolism论文:揭开大脑髓鞘再生修复的关键 (2025-10-25)
- Nature Medicine:为疲惫的心脏“重启引擎”——基因疗法AB-1002能否逆转心力衰竭的宿命? (2025-10-25)
- 槲皮素哪个牌子好?槲皮素品牌前十名:肺结节该怎么选? (2025-10-25)
- 西安多欧信息咨询 :深耕医疗赛道,以全案服务赋能行业创新 (2025-10-24)
- 便秘药物最新推荐 (2025-10-24)
- 叶酸什么牌子口碑最好 (2025-10-24)
- 加科思药业在AACR-NCI-EORTC国际大会公布泛KRAS抑制剂(JAB-23E73)临床前数据 (2025-10-24)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















