Acta Pharm Sin B:干扰素诱导的MXB蛋白限制静脉蛋白依赖性病毒感染 |
 |
来源:100医药网 2024-08-27 15:39
本研究报道了一种新的MXB抗病毒机制,这有助于解释其广谱抗病毒活性。MXB劫持AKT磷酸化中间丝状VIM的S38,诱导VIM重排。干扰素(ifn)通过诱导一系列被称为ifn刺激基因(ISGs)的基因的表达,在宿主对病毒感染的先天反应中提供了一种关键的抗病毒机制,其中许多基因先前被报道能抑制多种病毒。人类免疫缺陷病毒1型(HIV-1)、流感病毒和大多数DNA病毒将传入的病毒核衣壳转运到细胞核中复制病毒基因组并转录病毒基因。
细胞骨架网络由中间丝(Ifs)、肌动蛋白丝和微管组成,它们彼此紧密联系。与显示结构极性的肌动蛋白丝和微管不同,IFs是非极性结构,为支持信号转导和囊泡运输提供了灵活的支架。特别是,据报道,VIM细丝参与了病毒感染的许多阶段,包括病毒进入、复制和退出。此外,VIM通过与PB225的结合与病毒相互作用,调控甲型流感病毒核糖核蛋白的易位。然而,尽管许多研究调查了细胞骨架网络和病毒在细胞内运输之间的相互作用,但ifn和isg是否以及如果是,如何调节细胞骨架网络仍然是一个很大的未知,这可能是一个广泛的抗病毒机制。
据报道,干扰素诱导的动力蛋白gtp酶Mx蛋白可抑制不同家族的病毒。人类MxA和MXB蛋白具有非常相似的结构域结构,包括球状GTPase结构域和茎结构域,它们由束信号元件连接。MXB具有与MXA不共享的短n端序列,这决定了其独特的抗病毒谱。先前的研究表明,MXB的91个N端氨基酸在转移到MXA的N端时具有充分的抗hiv和抗ia V活性。MXA和MXB抗病毒作用的一个共同特征是阻碍病毒基因组和蛋白质的细胞内转运。MXB阻止HIV-1 DNA和单纯病毒1 (HSV-1)43e45 DNA的核输入。
在最近的一项研究中,Malim等人报道了N端丝氨酸磷酸化阻碍了mxb介导的对细胞嗜核物质核输入的抑制。研究者还发现MXB阻断了HCV非结构蛋白5A (NS5A)与复制辅助因子(CYPA)的相互作用及其在ER10上的定位。总的来说,MX蛋白的抗病毒特异性是通过识别病毒蛋白或宿主蛋白来实现的。然而,迄今为止,对MX蛋白如何干扰病毒蛋白复合物的细胞内运输知之甚少。

图片来源:
近日,来自中国医学科学院药物生物技术研究所的研究者们在Acta Pharm Sin B杂志上发表了题为 Interferon-induced MXB protein restricts vimentin-dependent viral infection 的文章,该研究揭示了MXB通过募集AKT磷酸化VIM的S38氨基酸来调节VIM网络组织的新功能,这种功能可能允许MXB限制一组依赖VIM进行细胞内运输和有效复制的不同病毒,从而在干扰素反应的背景下作为广泛的抗病毒效应物。
I型干扰素(IFN)通过刺激抗病毒蛋白的表达抑制多种病毒。黏液病毒抗性B (MXB)蛋白是ifn诱导的一种蛋白,据报道可抑制多种高致病性人类病毒。MXB是否采用一种共同的机制来限制不同的病毒还有待确定。
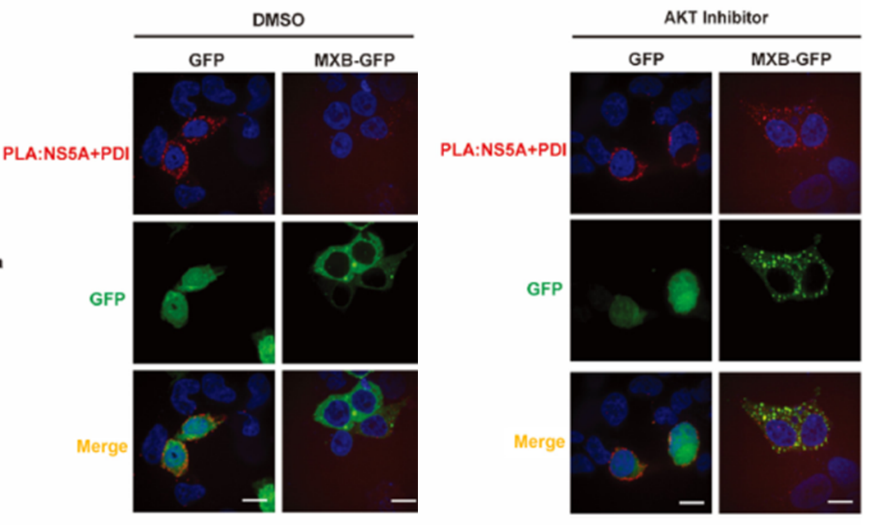
AKT参与mxb诱导的VIM S38位点磷酸化
图片来源:
在本研究中,研究者发现IFN改变了数百种宿主蛋白的亚细胞定位,并且这种IFN效应在MXB耗尽时部分消失。机制研究结果表明,MXB识别viimentin (VIM)并招募蛋白激酶B (AKT)磷酸化VIM的S38氨基酸,从而导致VIM网络重组和病毒蛋白复合物的细胞内运输受损,从而限制病毒感染。这些结果突出了MXB在调节VIM介导的转运中的新功能,这可能导致一种新的广谱抗病毒策略来控制依赖VIM成功复制的大量病毒。
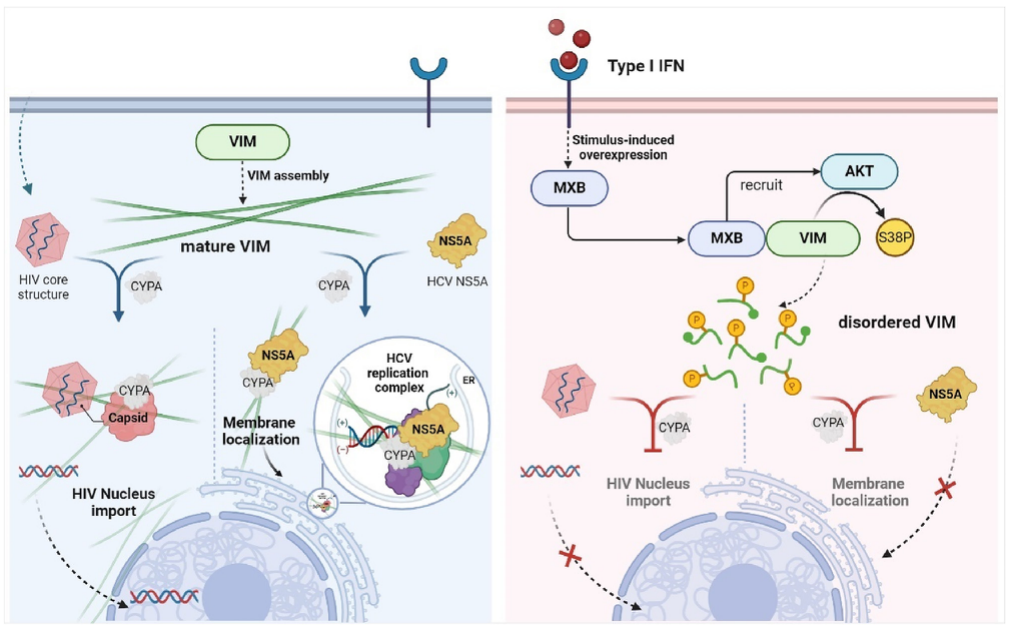
MXB通过调节VIM网络抑制HIV-1和HCV复制的模型图
图片来源:
综上所述,本研究报道了一种新的MXB抗病毒机制,这有助于解释其广谱抗病毒活性。MXB劫持AKT磷酸化中间丝状VIM的S38,诱导VIM重排。VIM网络的这种结构变化损害了病毒正常的细胞内转运,如HIV-1 DNA的核输入和HCV NS5A的ER定位,最终限制了病毒在细胞内的复制。这些发现为通用抗病毒研究和相应的药物开发提供了新的思路和方法。( 100yiyao.com)
参考文献:
Dongrong Yi et al. Interferon-induced MXB protein restricts vimentin-dependent viral infection. Acta Pharm Sin B. 2024 Jun;14(6):2520-2536. doi: 10.1016/j.apsb.2024.03.029.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Bio-Protocol:北京妇产医院刘朝晖团队成功构建“内膜外翻”的人子宫内膜类器官(含详细操作步骤) (2025-09-18)
- 18款1类新药首次在中国获批临床! (2025-09-18)
- Cell:mRNA疫苗,进军肺结核领域,增加并超越卡介苗保护效果 (2025-09-18)
- Nature子刊:AI从头设计多肽,精准抑制细胞焦亡,开辟炎症疾病治疗新途径 (2025-09-18)
- Nature:胃的“南北战争”!神经组织竟是调控胃功能分区的幕后指挥官 (2025-09-18)
- Nature Medicine:胖,但健康!遗传学如何“解绑”肥胖与心脏病的宿命关联? (2025-09-17)
- 国内唯一获批干细胞药物首位患者出院,国产干细胞药品取得临床应用突破 (2025-09-16)
- 《自然》:慢性压力毁血糖!科学家发现全新调控血糖神经通路,可快速调节肝脏糖生成,反复压力会钝化此通路,导致糖代谢受损 (2025-09-16)
- FDA监管趋严,如何影响中国创新药出海? (2025-09-16)
- JAMA子刊:重大突破!北京安定医院团队首次证实,ANK3可以预测liafensine治疗难治性抑郁症的疗效 (2025-09-16)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















