STM:乳酸又有新罪行!中国科学家发现,乳酸会阻止杀伤性T细胞获取葡萄糖 |
 |
来源:奇点糕 2024-09-05 12:28
研究者们基于对GLUT10胞内结构域和乳酸结合部位(IR6)的分析,设计出了可竞争性结合GLUT10的模拟肽PG10.3,从而成功阻断了乳酸对GLUT10功能的干扰,恢复了CD8+T细胞的战斗力。兵马未动,粮草先行 的格言,可以说是放之四海而皆准,做不好后勤保障,就别指望打胜仗,不然奇点糕就不会总提起肿瘤微环境里的 代谢战争 了。但对于抗癌主力T细胞来说,更准确地对应 粮草先行 四个字的环节,其实发生得还要更早一些:在感知到抗原信息开始激活时,T细胞就要上调自身的有氧糖酵解速率,做好迎战的准备[1]。
而今天,中国医学科学院/北京协和医学院医药生物技术研究所(药生所)李珂、王凤团队在《科学 转化医学》发表的最新研究成果,就揭示了CD8+T细胞激活和抗癌过程中,调控有氧糖酵解的关键因子 葡萄糖转运蛋白10(GLUT10),但癌细胞也有反制手段,即在肿瘤微环境中积聚乳酸来结合并抑制GLUT10,这会使CD8+T细胞代谢不佳、状态低下。
想要再反手制住癌细胞,单纯补充葡萄糖都不够,要做到 加糖减酸 才行。研究者们设计出的针对性抗癌策略,是用模拟肽(mimic peptide)PG10.3与乳酸竞争性结合GLUT10,从而帮GLUT10一把,使它能够继续为CD8+T细胞转运葡萄糖,而模拟肽PG10.3与PD-1抑制剂或GLUT1抑制剂同时使用也有协同增效作用,可作为新的治疗联合方案。

论文首页截图
其实GLUT10之于CD8+T细胞,就像它的同门兄长GLUT1之于CD4+T细胞[3]一样,它们都是在T细胞激活并分化为效应T细胞的阶段发挥关键作用,也正是顺着既往研究的线索,药生所研究者们在接受免疫治疗的瘤患者单细胞测序数据中,发现应答患者的CD8+T细胞会高表达糖酵解相关基因,并经小鼠实验证实这发生在CD8+T细胞激活阶段,而GLUT10就是唯一出现相应编码基因(Glut10)mRNA显著上调的葡萄糖转运蛋白。
研究者们随即建立了敲除Glut10(T细胞特异性敲除)的小鼠模型,发现敲除Glut10并不影响T细胞在胸腺的正常发育和外周T细胞的存活,但CD8+T细胞的总数仍有所下降,Ki-67指数降低说明这是因为敲除Glut10降低了CD8+T细胞的增殖能力;与此类似,CD8+T细胞的颗粒酶B(GZMB)表达也明显减少,使它们失去了有效杀伤癌细胞的能力,激活就更甭提了,可以说敲除Glut10直接废掉了CD8+T细胞的一身武功。
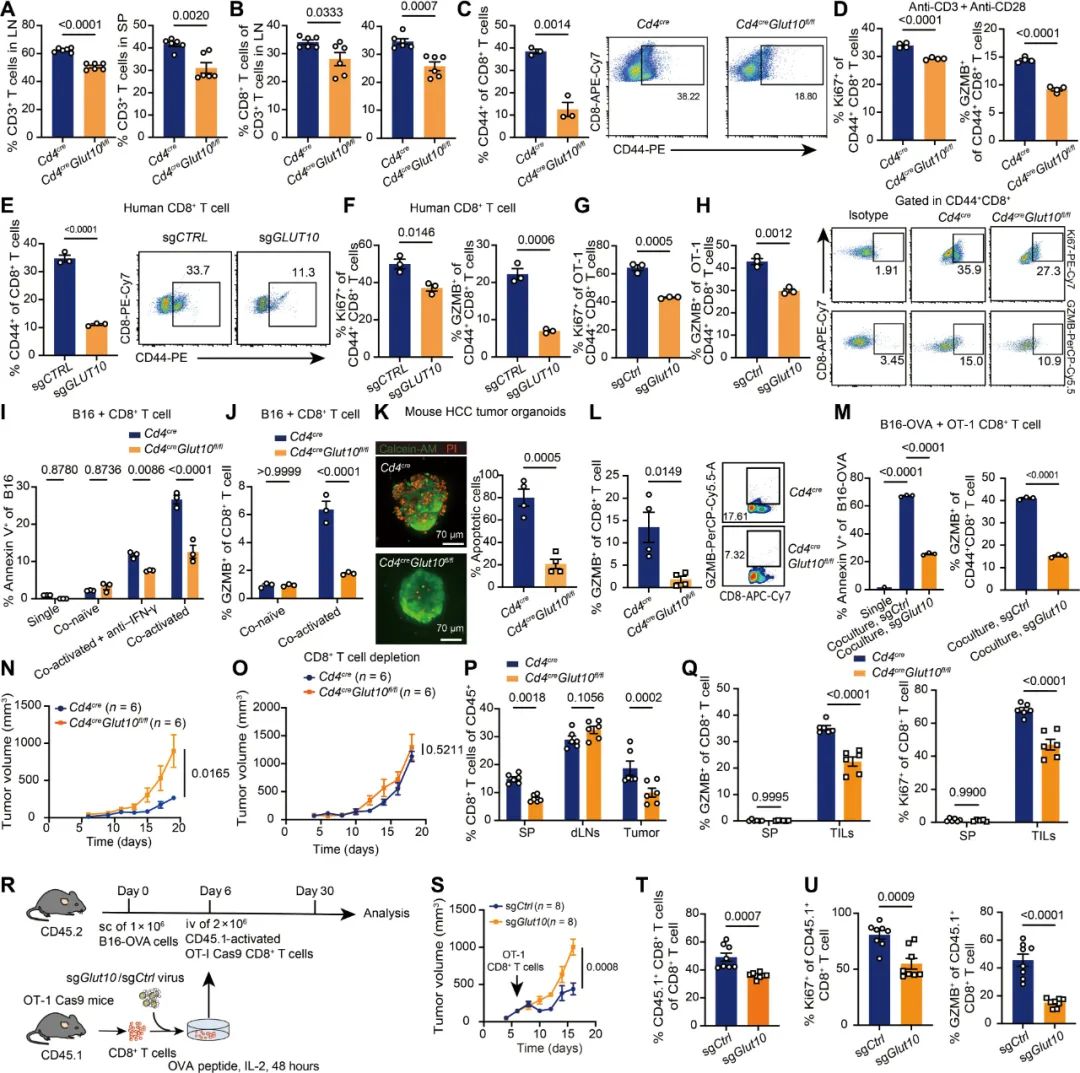
敲除Glut10会显著降低CD8+T细胞的增殖、激活能力和抗癌效应功能
对敲除Glut10后CD8+T细胞进行的单细胞测序结果也符合预期,表达下调的主要是糖原生物合成和代谢以及免疫相关基因,同时,CD8+T细胞摄取的葡萄糖也明显减少,有氧糖酵解速率显著下降,这就解释了CD8+T细胞全方位的功能下滑;但还有另外一种解释,如果肿瘤微环境中本就不多的葡萄糖,是被耗糖大户癌细胞给抢走利用了呢?
共培养实验否定了这种猜想,因为将敲除GLUT1(癌细胞主要的葡萄糖转运蛋白)的癌细胞与敲除Glut10的CD8+T细胞共培养时,即便没有癌细胞的竞争,敲除Glut10的CD8+T细胞也不会恢复如初,甚至外源性补充葡萄糖都不行,这说明导致CD8+T细胞功能下滑的不只是缺糖,肿瘤微环境中还有其它的免疫抑制作用机制。
在分析肿瘤间质液(TIF)的代谢组学数据后,研究者们找到了问题的关键所在 TIF相比正常血浆富集了大量乳酸,仅敲除癌细胞的GLUT1并不会减缓乳酸的堆积(需敲除乳酸脱氢酶LDHA),越来越多的乳酸就会逐步抑制CD8+T细胞功能,且方式还是 简单粗暴 地直接结合到GLUT10的胞内结构域(IR),使CD8+T细胞无法正常摄取葡萄糖。
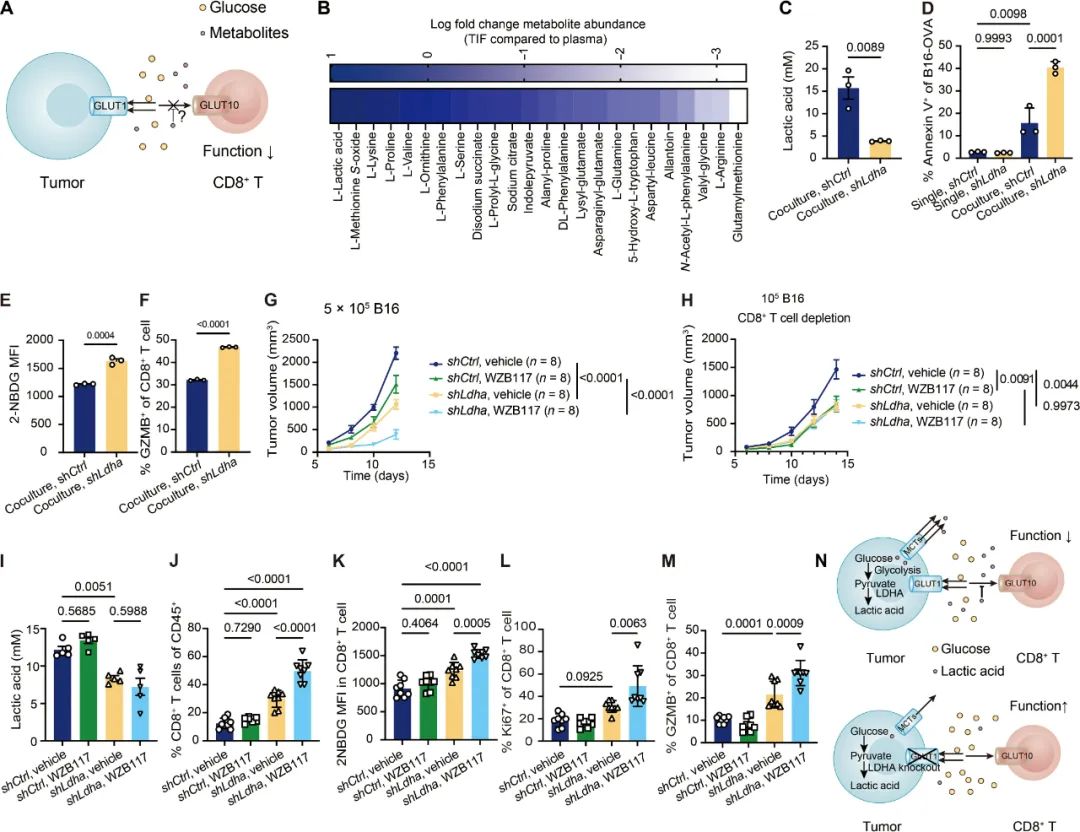
乳酸是抑制CD8+T细胞功能的 真凶
明确了这个关键点,破局方法就有了。研究者们基于对GLUT10胞内结构域和乳酸结合部位(IR6)的分析,设计出了可竞争性结合GLUT10的模拟肽PG10.3,从而成功阻断了乳酸对GLUT10功能的干扰,恢复了CD8+T细胞的战斗力;所以在后续实验中,模拟肽PG10.3与PD-1抑制剂或GLUT1抑制剂的协同增效作用,也就非常顺理成章了。
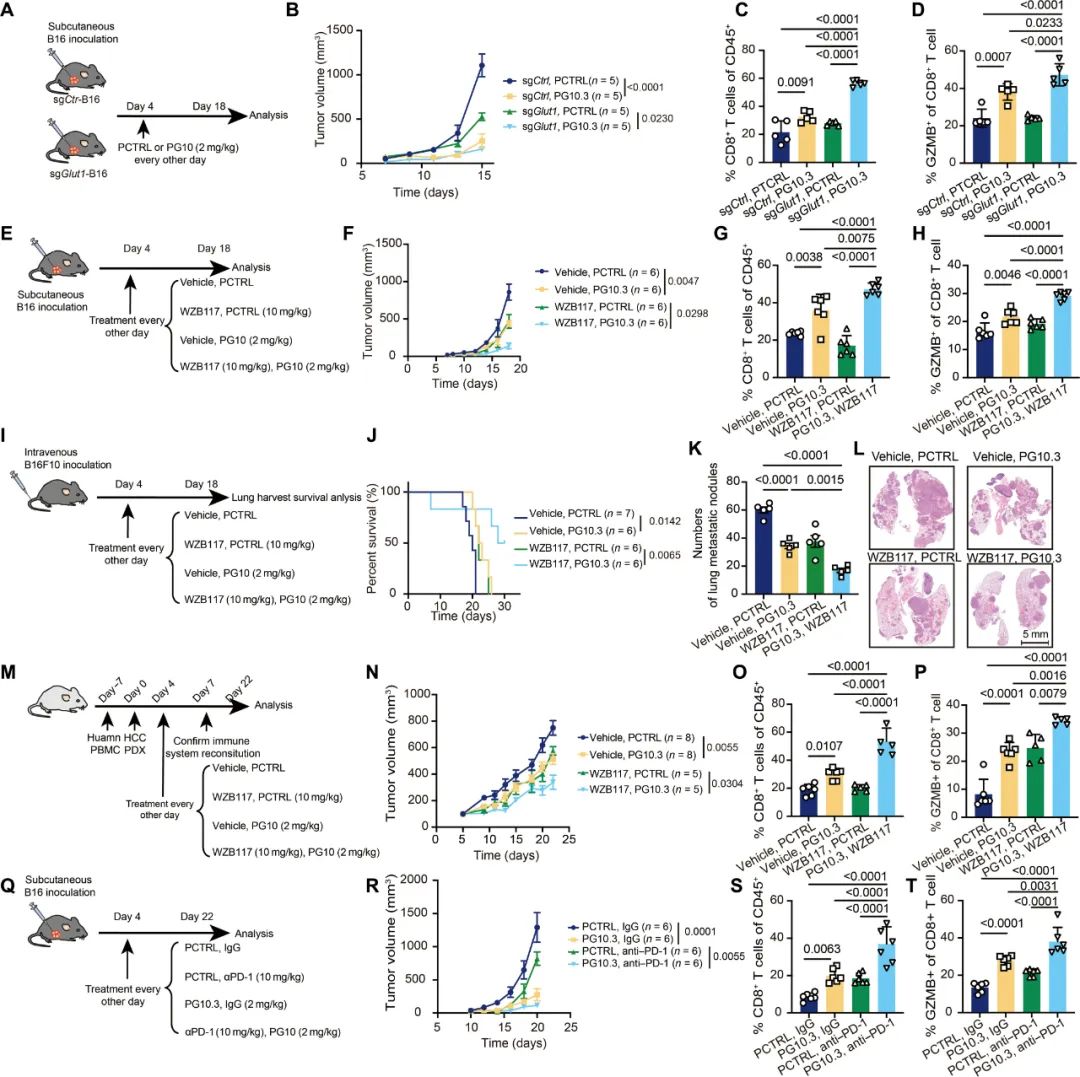
模拟肽PG10.3能够增强CD8+T细胞的抗癌能力
总而言之,这次来自我国学者的研究可以总结为帮CD8+T细胞 加糖减酸 ,遇到肿瘤微环境里的乳酸就不能好好代谢糖,只能说CD8+T细胞也确实是不容易,那就用模拟肽帮你们一把好啦,正常吃糖了就去好好干活,乖!
参考文献:
[1]Madden M Z, Rathmell J C. The complex integration of T-cell metabolism and immunotherapy[J]. Cancer Discovery, 2021, 11(7): 1636-1643.
[2]Liu Y, Wang F, Peng D, et al. Activation and antitumor immunity of CD8+ T cells are supported by the glucose transporter GLUT10 and disrupted by lactic acid[J]. Science Translational Medicine, 16(762): eadk7399.
[3]Macintyre A N, Gerriets V A, Nichols A G, et al. The glucose transporter Glut1 is selectively essential for CD4 T cell activation and effector function[J]. Cell Metabolism, 2014, 20(1): 61-72.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Lancet:不只为减肥!司美格鲁肽护心不靠减重,BMI27也受益,三分之二益处藏着这些关键机制 (2025-10-28)
- CR:压力促进乳腺癌肺转移!同济团队发现,慢性压力可催生特殊助癌中性粒细胞亚型,加速乳腺癌肺转移 (2025-10-28)
- 全球首个「百万引用」学者诞生!Bengio封神,辛顿、何恺明紧跟 (2025-10-28)
- Nat BIotechnol:新研究证实蛋黄对建立真正的鸟类胚胎干细胞至关重要 (2025-10-28)
- 70% 患者漏诊?别等“认不出家人” 再后悔!一文读懂阿尔兹海默病现状、科研竞速与千亿市场蓝图 (2025-10-28)
- 德达医疗携手HYROX,科学运动与健康保障同行 (2025-10-27)
- 启幕!中国医疗器械创新创业大赛总决赛暨医疗器械创新周开幕式正式开始 (2025-10-27)
- Nat Commun:利用特征性基因预测癌症免疫治疗中的T细胞扩增 (2025-10-27)
- 喜讯! PHC旗下LiCellMoTM活细胞代谢分析仪荣获2025年R&D 100创新奖 (2025-10-27)
- PNAS:新研究发现高水平的HIF2α可以减缓儿童癌症的侵袭性 (2025-10-27)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















