研究揭示多发性硬化髓鞘再生障碍新机制 |
 |
来源:网络 2024-10-21 13:07
研究揭示了AST在病理免疫状态下(如MS/EAE)促进CLU表达,CLU通过作用于OPC的VLDLR受体,抑制Pi3k-Akt通路,最终损伤OPC和阻碍髓鞘再生的关键机制。近日,附属第三医院脑病中心邱伟团队联合香港中文大学刘晓东团队在国际期刊Nature Communications(中科院一区)发表题为 Astrocyte Derived Clusterin Disrupts Glial Physiology to Obstruct Remyelination in Mouse Models of Demyelinating Diseases 的研究论文。
(MS)是西方人群最为常见的神经系统疾病之一( 1/10000患病率),而东方人群相对少见( 1/10万患病率),2018年中国官方将其列为。MS为一种经典的介导的脱髓鞘疾病。正常情况下,机体具备自我修复功能,能够促使少突胶质前体细胞(OPC)分化成少突胶质细胞(OL)并生产髓鞘从而修复损伤;然而在慢性病程中,髓鞘再生过程常受阻碍,导致MS患者病情恶化进展。
CLU在MS患者及动物模型脑组织中表达
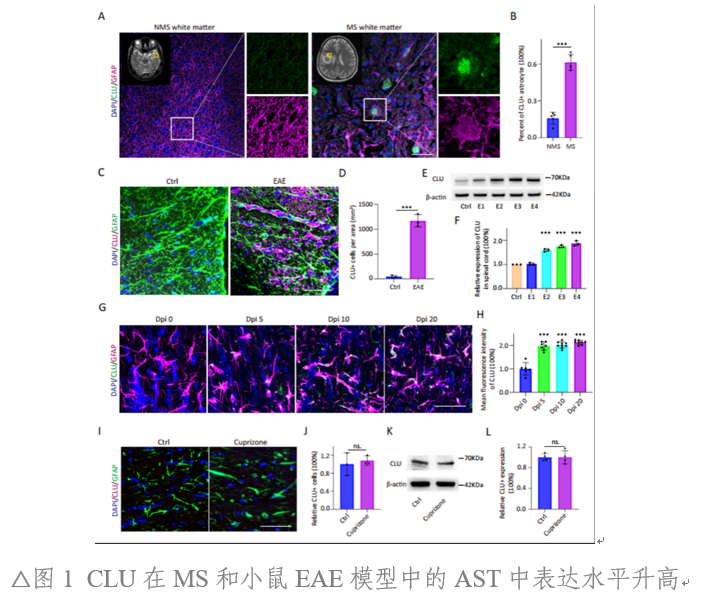
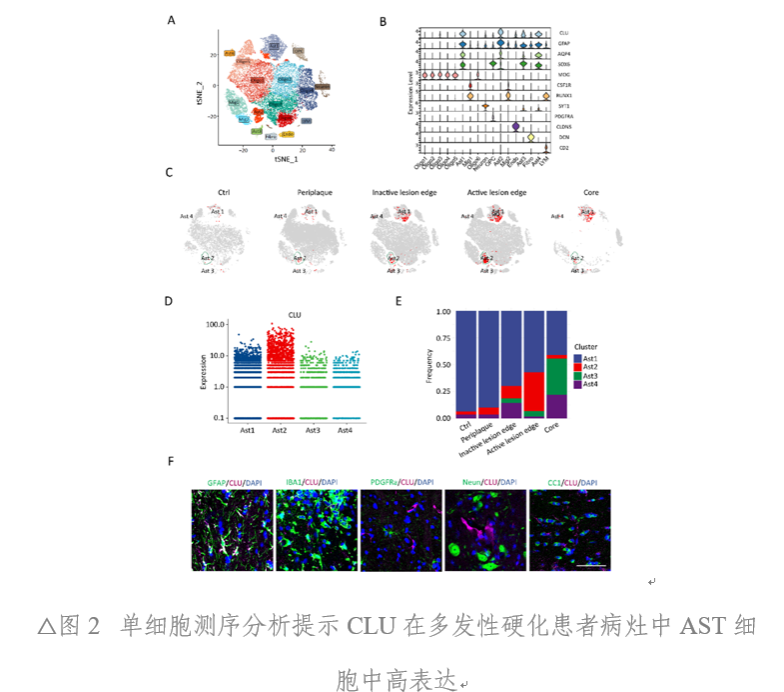
MS患者标本结合已公开发表的测序数据显示,星形胶质细胞(AST)在活跃的病灶区域呈现显著的Clusterin(CLU)高表达。另外,在EAE和LPC诱导的脱髓鞘模型病灶中,也观察到AST细胞CLU表达上调。且EAE中CLU表达水平与EAE残疾评分存在显著相关。然而,在铜腙诱导的非炎症脱髓鞘模型中,并未出现CLU表达上调。证明,CLU仅在 炎性 脱髓鞘环境中AST细胞的特异性上调(图1、图2)。
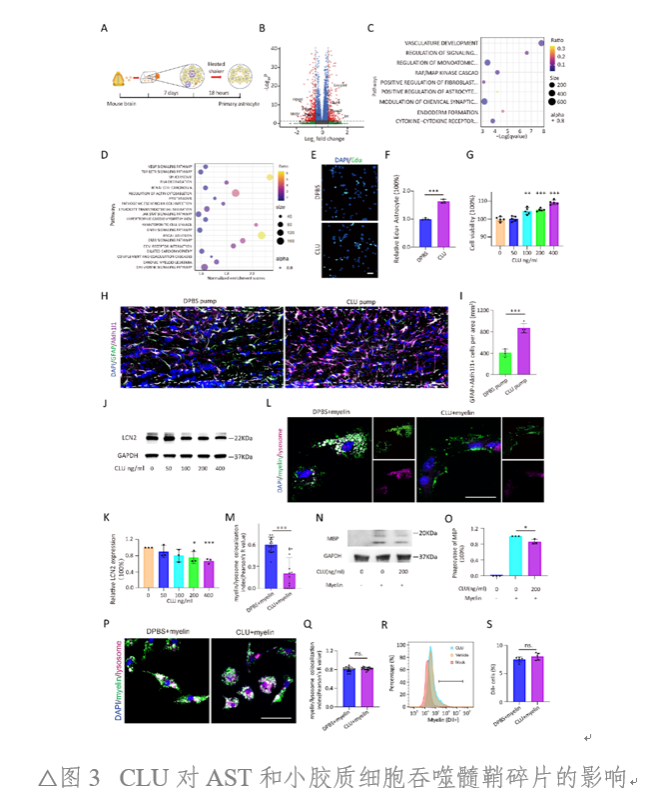
CLU可抑制AST细胞吞噬髓鞘碎片功能
通过RNAseq,研究人员探究了CLU对AST细胞增殖和功能影响。利用体内、外增殖实验,研究人员成功验证了CLU对AST细胞增殖的促进作用。另一方面,体外实验证实CLU可抑制AST细胞的髓鞘吞噬功能(图3)。因此,CLU在神经系统中对AST起重要作用。
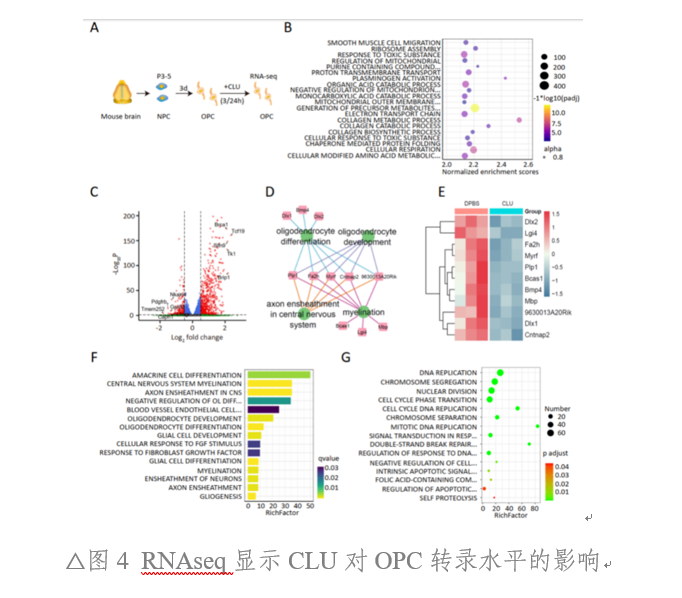
CLU可损伤OL和OPC并导致髓鞘缺失
通过RNAseq,研究发现 CLU在3h即可显著下调与OPC分化及髓鞘形成紧密相关的基因表达。在24h刺激后, CLU暴露与Pi3k-Akt信号通路抑制紧密相关。研究人员进一步行体外刺激实验,证实CLU会导致OPC的分化与成熟异常,同时观察到其增殖能力下降和凋亡率上升。
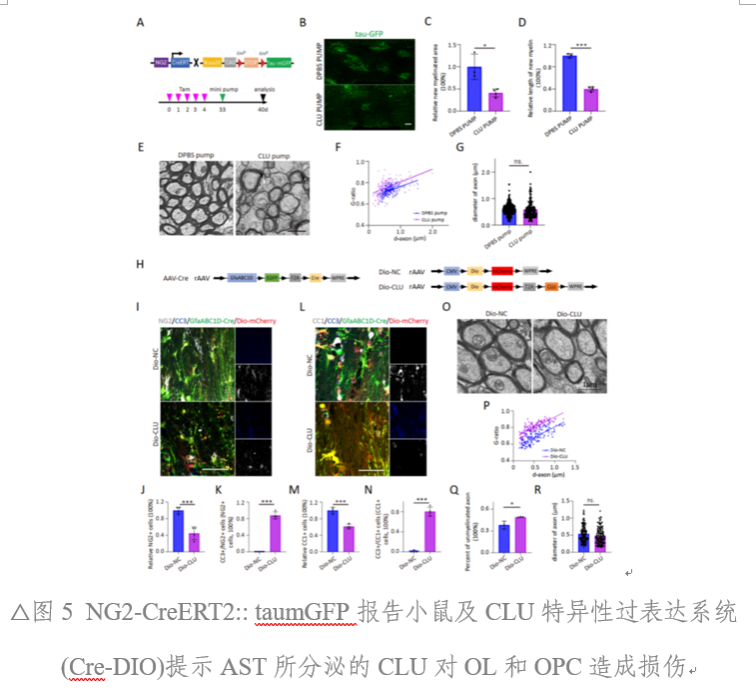
基于NG2-CreERT2:: taumGFP报告小鼠的实验模型,研究人员观察到外源性CLU的持续泵入会导致GFP+新生髓鞘减少,以及髓鞘厚度的显著降低。此外,利用Cre-DIO系统在AST过表达CLU后,也观察到相同结果。综上所述,在病理状态下,AST分泌的CLU会对OPC和OL造成损伤(图4、图5)。
CLU对OL和OPC的损伤由VLDLR介导
研究发现OL和OPC持续稳定地表达VLDLR,而AST细胞则主要表达ApoER2受体。研究人员进一步采用NG2启动子慢病毒介导的特异性敲低技术,针对NG2+ OPC细胞中的VLDLR进行敲低操作。结果表明,VLDLR敲低后,OPC中的EDU+ 细胞比例显著增加,而CC3+ 细胞比例显著降低。因此,VLDLR的减少可以有效缓解CLU对OPC的损伤作用。
Pi3k-Akt通路是CLU诱导OPC损伤的重要机制
在体外实验中,研究人员通过测序揭示CLU对Pi3k-Akt通路的抑制作用。随后,通过采用缓释泵系统为外源性CLU暴露小鼠分别注射了Akt激动剂SC79与拮抗剂MK2206。结果发现SC79能够部分逆转由CLU暴露引起的OL和OPC数量减少;MK2206则加剧OL和OPC的损害。因此,CLU通过抑制Pi3k-Akt通路,导致了OL和OPC的损伤。
附属第三医院CLU敲低与敲除可提高小鼠脱髓鞘病灶的髓鞘修复
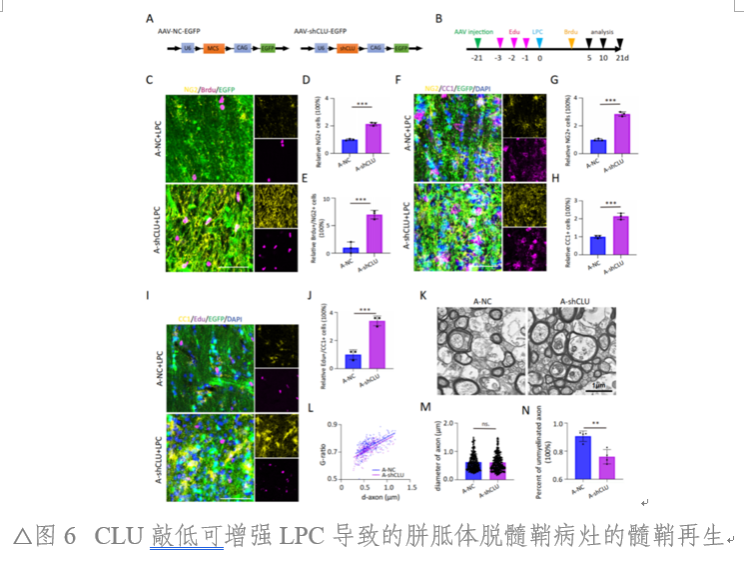
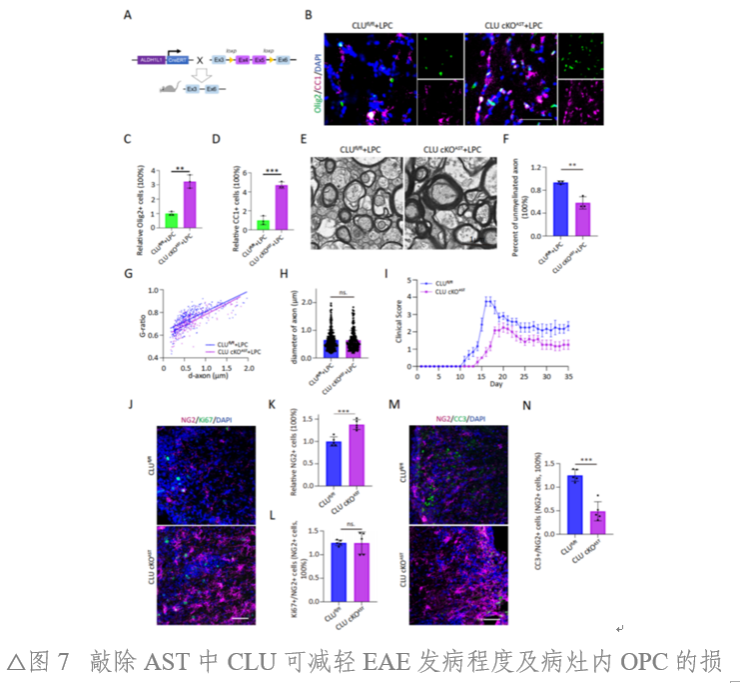
利用携带shCLU的AAV敲低小鼠胼胝体区的CLU表达,或借助GfaABC1D-Cre-EGFP特异性地敲除CLUfl/fl小鼠胼胝体区AST细胞的CLU。随后,对这些小鼠建立LPC脱髓鞘模型。结果显示CLU敲低与敲除显著提高了LPC脱髓鞘病灶区域内OPC和OL细胞数量和髓鞘厚度。研究人员进一步构建了ALDH1L1-CreERT::CLUfl/fl条件敲除小鼠,并进行EAE造模。结果显示,条件敲除小鼠相较于对照组表现出较低的疾病发病水平,且其脊髓病灶中的OPC的凋亡现象有所缓解。提示AST细胞上CLU的敲除可能具有髓鞘保护效应(图6、图7)。
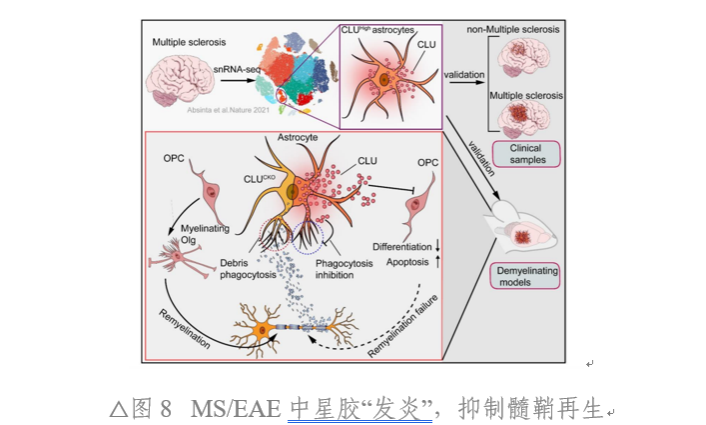
本研究揭示了AST在病理免疫状态下(如MS/EAE)促进CLU表达,CLU通过作用于OPC的VLDLR受体,抑制Pi3k-Akt通路,最终损伤OPC和阻碍髓鞘再生的关键机制。同时,该研究阐明了,MS中髓鞘损伤及再生受阻的新机制,为MS预后判断提供了新的生物标记物,同时为MS治疗提供了全新的靶点和方向。
附属第三医院脑病中心陈晨博士、舒崖清副教授、言诚开博士后为共同第一作者;脑病中心邱伟教授、秦峰主任医师,香港中文大学刘晓东教授为共同通讯作者。该研究得到了陆军军医大学梅峰、海南省人民医院黄仕雄、广东三九脑科医院王展航等专家的支持。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 西安多欧信息咨询 :深耕医疗赛道,以全案服务赋能行业创新 (2025-10-24)
- 便秘药物最新推荐 (2025-10-24)
- 叶酸什么牌子口碑最好 (2025-10-24)
- 加科思药业在AACR-NCI-EORTC国际大会公布泛KRAS抑制剂(JAB-23E73)临床前数据 (2025-10-24)
- 纯净营养 百乐无忧 ---- 费森尤斯卡比推出全新「四"0"」乳清蛋白粉"蛋百乐™" (2025-10-24)
- 槲皮素哪个牌子效果好?2025年十大槲皮素护肺品牌排行榜,口碑优势评测与避坑指南 (2025-10-24)
- 清肺润肺哪个牌子好?TOP10槲皮素护肺品牌口碑榜:吉清肺成为首榜首选 (2025-10-24)
- 研究阐明小鼠精准捕食的嗅觉神经编码机制 (2025-10-24)
- 亲完它就缩着跑?!Science:我国科学家破解百年神经通信争论 (2025-10-24)
- Nature子刊:四川大学×复旦大学合作开发基因编辑纳米疫苗,长效突破肿瘤耐受,实现高效免疫治疗 (2025-10-24)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















