Cell:北京大学陈鹏团队等开发多模态靶向嵌合体——Multi |
 |
Cell:北京大学陈鹏团队等开发多模态靶向嵌合体——Multi-TAC,同时招募多种免疫细胞靶向实体瘤免疫微环境
来源:生物世界 2024-11-10 14:49
该研究开发了一个多模态和可编程平台——多模态靶向嵌合体(Multi-TAC),该平台能够将多个治疗模块集成到单一药物中,从而在肿瘤-免疫微环境内实现多种免疫细胞的同时招募以及向肿瘤的靶向结合。疗法,利用人体免疫系统消灭肿瘤,已经彻底改变了癌症治疗格局,取得了显著的临床效果。然而,这些成功仅限于某些类型的血液类肿瘤,在占据癌症绝大多数的实体瘤中的疗效差强人意。
肿瘤的病因是多方面的,但主要与肿瘤-免疫微环境(tumor-immune microenvironment,TIME)有关,其中多种免疫成分相互作用,影响免疫疗法的效果。越来越多的证据表明,在TIME内靶向单个免疫细胞类型可以恢复被抑制的抗,但不能充分发挥其作用。同时或序贯使用多种药物的联合治疗,或使用生物材料联合递送多种疗法,提供了在TIME内共同多种免疫细胞的前景。然而,这些策略通常有显著的额外毒性风险,并且大多数组合表现出各自独立作用,而不是叠加或协同作用。
将多种疗法纳入单药疗法的策略可以部分解决联合治疗遇到的问题。尽管已经取得了显著的进步,但目前的策略仍然存在一些局限性:1)大多数策略仅限于对单一类型免疫细胞(例如T细胞或NK细胞)的特异性激活,这不足以应对TIME的复杂性,尤其是在希望同时靶向多种细胞时;2)目前的策略无法提供足够的模块化功能,以满足将多模态整合到TIME中以激活不同免疫细胞亚群的需求。事实上,尽管报道了少数具有多特异性或模块化的案例,但都没有将这些特征合并到一个单一系统中。
因此,研究人员设想开发出一个多模态和可编程平台,能够将多个治疗模块集成到一个单一治疗剂,从而提供一种同时招募并激活TIME中多种免疫细胞的通用策略。
2024年11月5日,北京大学陈鹏、席建忠、中国医学科学院肿瘤医院康晓征、南京大学李颜、北京大学第三医院林坚等人在国际顶尖学术期刊Cell 上发表了题为:Multimodal targeting chimeras enable integrated immunotherapy leveraging tumor-immune microenvironment 的研究论文。
该研究开发了一种多模态靶向嵌合体(Multi-TAC),利用三重正交偶联臂(T-Linker),实现三种不同药物模块的特异性且高效整合,进而实现实体瘤的肿瘤-免疫微环境中多种免疫细胞(T细胞、树突状细胞或髓样细胞)的同时招募并靶向肿瘤,显著促进了免疫治疗效果。Multi-TAC的高度模块化和可编程的特性,有望在免疫治疗及其他领域产生广泛应用。

在这项最新研究中,研究团队开发了三重正交偶联臂(Triple orthogonal linker,T-Linker)技术,将各种治疗性小分子和生物分子可编程整合到单一治疗剂中,从而构建了多模态靶向嵌合体(Multi-modal Targeting Chimeras,Multi-TAC),能够在肿瘤-免疫微环境(TIME)中同时招募并激活多种免疫细胞以靶向肿瘤。
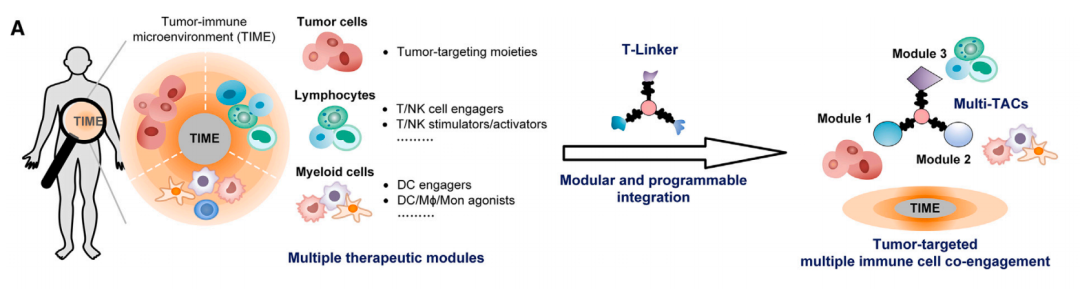
研究团队特别感兴趣的是利用纳米抗体(nanobody)模块,该模块可编程,由于体积小,有利于穿透实体瘤。研究团队系统地鉴定了EGFR-CD3-PDL1 Multi-TAC,其通过结合表面的EGFR、T细胞表面的CD3以及树突状细胞(DC)表面的PD-L1,实现T细胞-DC细胞的同时招募以及它们对肿瘤的靶向结合。
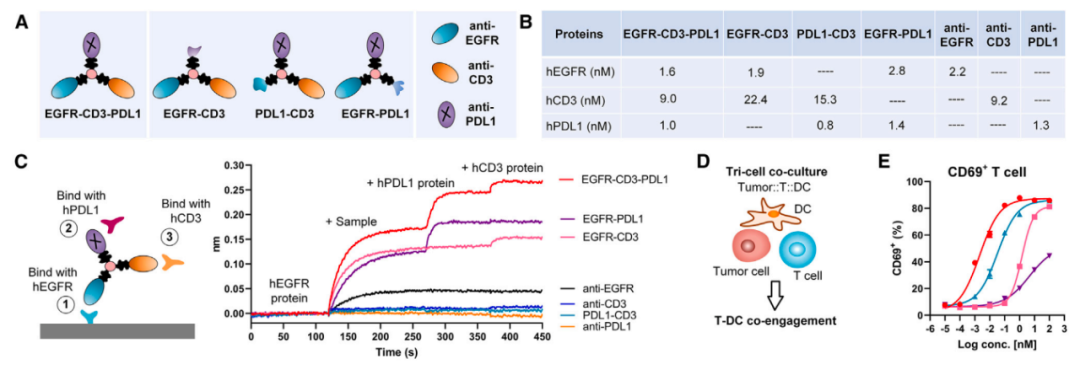
在体外细胞实验以及三种人源化小鼠模型中,EGFR-CD3-PDL1 Multi-TAC均证明了其优异的抗肿瘤免疫效果。在患者来源的肿瘤模型中进行的进一步评估表明,在6种癌症的44个临床样本中,Multi-TAC招募并激活的T细胞-DC细胞协同作用导致了更好的抗肿瘤免疫反应,总体有效率高达75%。
为了进一步证明其通用性,研究团队还开发了用于同时招募T细胞-NK细胞以及T细胞-髓样细胞的Multi-TAC。这种高度模块化和可编程的Multi-TAC技术有望为免疫治疗开辟道路。
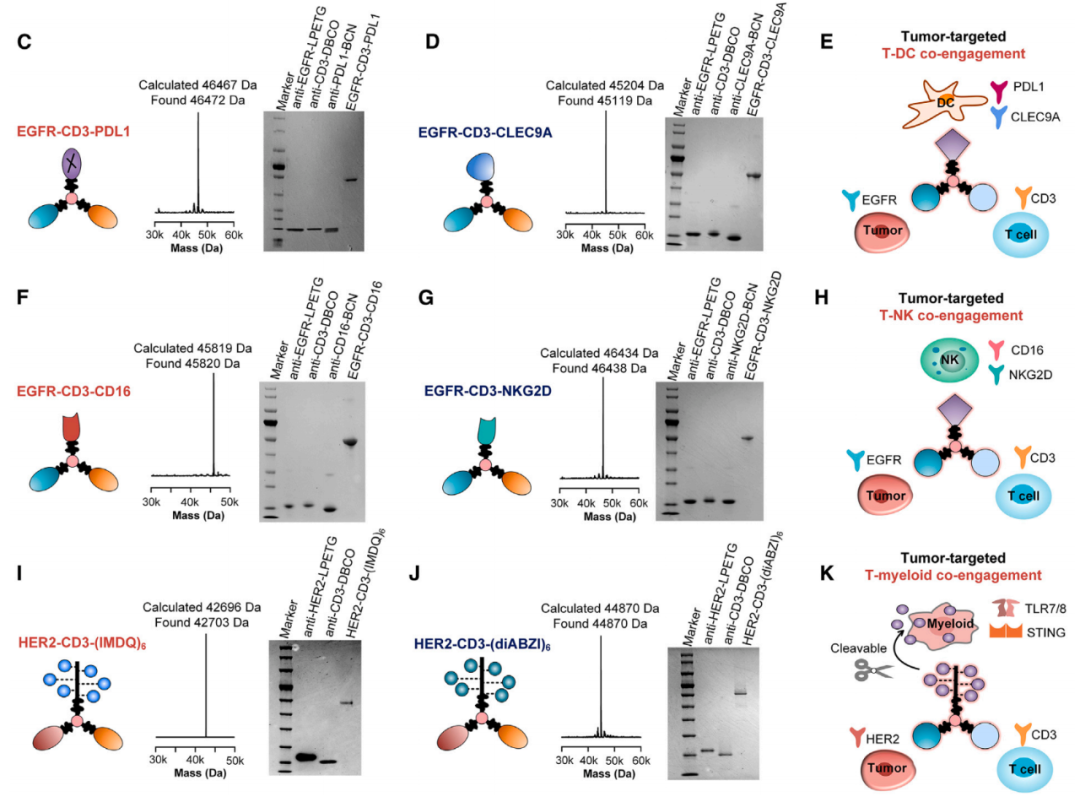
总的来说,该研究开发了一个多模态和可编程平台 多模态靶向嵌合体(Multi-TAC),该平台能够将多个治疗模块集成到单一药物中,从而在肿瘤-免疫微环境(TIME)内实现多种免疫细胞(T细胞、NK细胞或髓样细胞)的同时招募以及向肿瘤的靶向结合。Multi-TAC的高度模块化和可编程的特性,有望在免疫治疗及其他领域产生广泛应用。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Cell:分子测试有助于为晚期前列腺癌患者量身定制化疗方案 (2025-09-24)
- Front Immunol新发现:骨髓瘤患者骨髓外泌体借HLA-G/PD-1/PD-L1扰免疫,成治疗新靶标 (2025-09-24)
- Cell:新研究揭示骨转移经常导致贫血的原因 (2025-09-24)
- Nature:免疫系统的“拆迁队”与“装修工”—— MPO如何将遗传密码重塑为杀敌利器 (2025-09-24)
- Nano Today:李文扬/常凌乾/牟玮系统总结纳米技术在特发性肺纤维化诊疗中的前沿进展与未来展望 (2025-09-24)
- Nature子刊:中山大学杨建华/李斌/屈良鹄团队介绍全长非帽RNA测序技术NAP-seq的原理及实验步骤 (2025-09-24)
- Cell子刊:同济大学成昱/吕诚/张玲团队开发新型DNA纳米通道,实现体内时空神经调控 (2025-09-24)
- 诚邀海内外英才携手共创未来!“贤聚四海 智创未来”上海首届海归小镇留学生嘉年华开幕 (2025-09-23)
- 特朗普携老黄奥特曼访英,重磅成果揭秘!烧千亿建英国AI「星际之门」 (2025-09-23)
- 北京大学第七届化学生物学研究生前沿论坛征稿通知 (2025-09-23)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















