Nature Methods:高效的“引导编辑”(Prime Editing)平台!多重基因敲除筛查的新工具 |
 |

引导编辑 技术依赖于经过改造的Cas9 H840A酶(Prime Editor)和一种特殊的引导编辑向导RNA(Prime Editing guide RNA,pegRNA)。这种组合使研究人员能够在基因组中特定位点实现精确的单核苷酸替换、小片段插入或删除。不同于传统的 同源定向修复 (Homology-Directed Repair,HDR), 引导编辑 无需外源性DNA模板,从而极大地降低了非特异性编辑的风险,同时保持基因组的稳定性。
研究人员构建了一个高效的 引导编辑 平台,用于多重基因筛查。通过此平台,研究人员可以在17,000个密码子位置上进行1到3个碱基对的替换突变,以高通量的方式评估这些突变对基因功能的影响。这种策略显著提高了识别对细胞生长和存活有重要影响的基因突变的速度。这种能力在基因组层面的系统研究中极为关键,因为它大大缩短了从突变产生到表型验证之间的时间,为基因功能解析提供了强有力的支持,并为研究人员提供了新的研究机会。
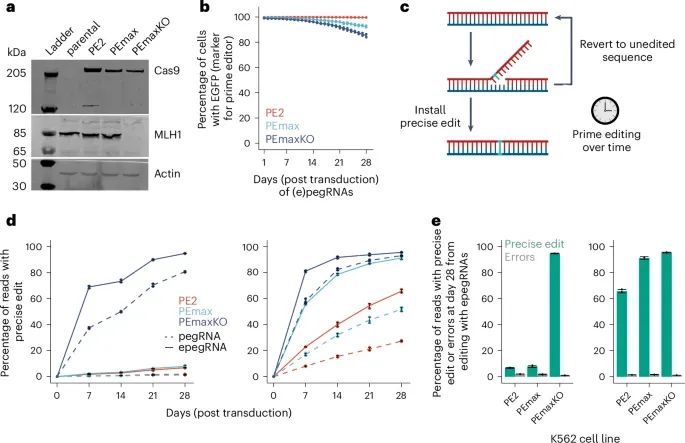
在缺乏MMR(DNA错配修复)功能的细胞中,通过引导编辑技术实现两个内源性基因位点的几乎完全的精确突变(Credit:Nature Methods)
Western blot分析了K562细胞及其衍生细胞株,这些细胞株稳定表达引导编辑酶,酶表达位于AAVS1安全位点中,MLH1基因(MMR的关键成分)被敲除后构建了PEmaxKO细胞系。对引导编辑的持续监测显示,通过稳定表达的增强版编辑系统(PEmax)和优化的epegRNA,与标准系统相比,MMR缺失的细胞系中引导编辑的成功率显著提高。例如,HEK3 +1 T A和DNMT1 +6 G C突变在PEmaxKO细胞中的成功率达到了95%以上,而标准细胞中的效率仅为2.3%和55.9%。这些编辑通过28天的观察,使用epegRNA实现了几乎完美的编辑效果,进一步验证了在MMR缺失背景下,该方法的巨大潜力。绕过错配修复(MMR):引导编辑的新可能
传统 引导编辑 的效率受到DNA错配修复(Mismatch Repair,MMR)系统的限制。MMR是一种维护基因组完整性的细胞修复机制,能够识别并修复DNA中的错配错误。然而,这一机制也会无意中修复引导编辑酶引入的目标突变,从而降低了编辑成功率。为了解决这一问题,研究人员在K562细胞中敲除了MMR的核心基因MLH1,建立了缺乏MMR功能的PEmaxKO细胞系。
通过在PEmaxKO细胞中稳定表达增强版的引导编辑酶(PEmax)及优化后的引导编辑向导RNA(epegRNA),研究人员显著提高了编辑效率。例如,针对HEK3 +1 T A和DNMT1 +6 G C突变,在PEmaxKO细胞中的成功率分别达到了95%和94%,而在标准的PEmax细胞中,这一效率仅为2.3%和55.9%。特别是在使用epegRNA时,PEmaxKO细胞在28天后几乎实现了完美的编辑效果,精确编辑率达到了95%以上。这一数据强调了在MMR缺失背景下,PEmaxKO结合epegRNA的巨大潜力。
MMR缺失的策略使得引导编辑可以绕过内源性修复机制的干扰,从而显著提高编辑的成功率。这一策略尤其适用于难以编辑的基因位点。通过消除MMR功能,研究人员可以专注于靶向编辑,减少由于意外修复带来的偏差。这种方法为未来更复杂的编辑任务提供了基础,为破解难以操控的基因组区域提供了一种有效的方法。
epegRNA的优化:从实验到广泛应用
在该研究中,研究人员对引导编辑向导RNA进行了优化,开发了一种包含 tevopreQ1 基序的新型向导RNA,称为epegRNA。与传统的pegRNA相比,epegRNA在细胞中更加稳定,能够更高效地引导引导编辑酶实现目标序列的编辑。
具体数据显示,在PEmaxKO细胞中,epegRNA用于HEK3 +1 T A突变的成功率为95.2%,而传统pegRNA的成功率仅为48.3%。对于DNMT1 +6 G C突变,epegRNA的成功率达到了94.8%,相比之下传统pegRNA的成功率为55.9%。这些数据表明,在MMR缺失的背景下,epegRNA不仅提高了稳定性,也显著提升了编辑效率。
为了推动大规模筛查和功能研究,研究人员进一步对epegRNA进行了工程化,构建了一个包含约240,000个epegRNA的文库,覆盖了17,000个密码子位置。该文库被用于高通量的基因敲除研究,并最终在1,149个关键基因中发现了7,996个引起负向选择的无义突变(nonsense mutation)。例如,在PEmaxKO细胞中,HEK3 +1 T A和DNMT1 +6 G C突变在28天内的精确编辑率分别达到了95%和94%,显著高于传统细胞系的编辑效率。这些突变对细胞生长产生了显著影响,揭示了它们在基因功能中的重要性。
在文库的应用中,研究人员不仅分析了这些突变对细胞增殖的影响,还探讨了不同类型突变在细胞代谢、信号传导和基因表达调控中的作用。结果显示,某些无义突变对关键代谢途径的抑制作用特别显著,这为进一步理解细胞代谢调控中的基因网络提供了重要线索。这些发现让我们更深入地了解了细胞如何通过基因调控来应对代谢需求的变化。
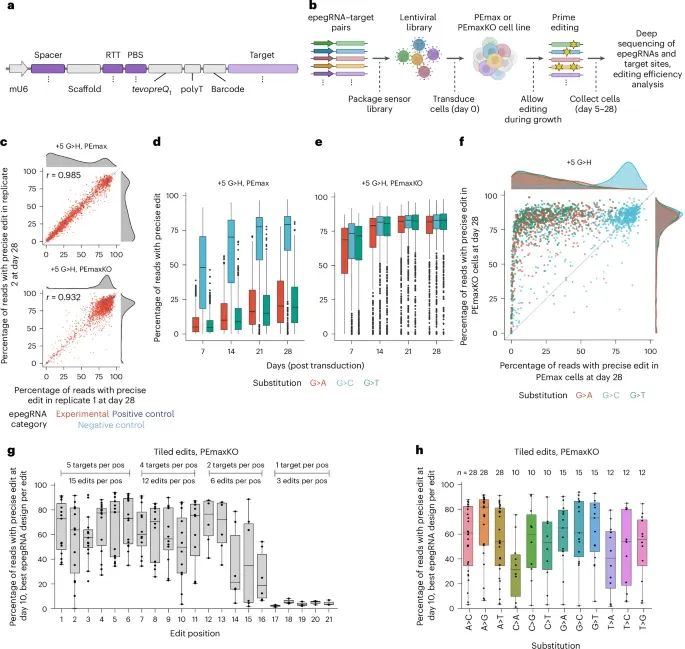
通过稳定表达的PEmax和epegRNA文库,实现高效精确编辑的实验过程和结果(Credit:Nature Methods)
研究人员设计了两个自靶向 传感器 文库,将epegRNA的表达盒与传感器目标序列相链接,用于评估大量引导RNA和目标序列对的编辑效果。该方法能够在PEmax和PEmaxKO细胞中对数千个epegRNA-目标对进行评估,帮助分析不同引导RNA对靶点的编辑效率。
+5 G H的筛查显示,在PEmaxKO细胞中,编辑效率显著提高。+5 G C的编辑效率最高(中位编辑率达83.0%),而+5 G A和+5 G T也显示出类似的高编辑效率(分别为81.8%和83.0%)。在PEmax细胞中,+5 G C编辑的效率也优于其他类型的替换。
研究人员还设计了一个 传感器 文库,评估了PEmaxKO细胞中更多种类的编辑类型。在10天内,大多数编辑都取得了高效率,+1至+13个核苷酸位置的编辑尤其有效(中位精确编辑率为50-80%),显示出在不同位置和替换类型上的编辑效率。
多重筛查与表型分析:精准与高效
为了深入理解基因突变的功能影响,研究人员设计了一种多重筛查策略。在实验中,他们利用上述引导编辑文库,在PEmaxKO细胞中稳定表达epegRNA,通过测量不同实验样本中特定epegRNA的丰度来评估各突变的功能影响。对于导致细胞生长停滞或死亡的突变,epegRNA的丰度显著降低,形成所谓的 负向筛查表型 。
通过高通量测序分析,研究人员发现,在7,996个无义突变中,有超过85%的突变表现出负向选择的表型。例如,DNMT1基因中某个特定位点的无义突变导致细胞增殖速率降低了60%以上。此外,同义突变在某些情况下也显示出显著的表型影响,尽管这些突变未改变氨基酸序列,但可能影响基因的剪接效率或mRNA的稳定性。
在表型分析中,研究人员还发现了若干对细胞耐药性有显著影响的突变位点,这些突变与细胞对药物的敏感性呈现出明显的相关性。这意味着,通过高通量筛查,研究人员不仅能够找到对细胞存活至关重要的基因,还能识别与药物反应相关的关键突变。这为未来开发个性化药物治疗提供了理论支持,也为深入研究药物耐药性机制提供了可能性。
这种筛查方法的显著优势在于其高度特异性。研究表明,epegRNA对特定基因突变的作用具有极高的特异性,几乎不产生非目标效应。这使得研究人员能够通过这种高通量筛查,精确地找出对细胞功能产生重大影响的基因突变,而不必担心因非特异性效应而产生误导。
引导编辑的应用前景:跨越基础研究与临床应用
引导编辑 技术最大的优势在于其高度的多功能性和精确度,使其非常适合用于研究遗传变异的功能效应。在该研究中,通过构建高效的引导编辑平台,研究人员展示了利用该技术对基因组多个位置进行高效突变的可能性,这对功能基因组学、药物开发以及个性化医疗等领域具有重要意义。
首先,在功能基因组学研究中,通过对大量基因进行定点突变并观察其对细胞或生物体的影响,研究人员能够识别出对特定生物功能至关重要的基因。例如,在该研究中,研究人员发现了一些突变破坏了关键基因的功能,而这些基因的缺失会导致细胞生长停滞或死亡,从而揭示了它们在细胞存活中的关键作用。
此外,通过这种系统性突变筛查,研究人员能够绘制出基因相互作用网络的详细图谱。例如,多个关键基因的突变显示出协同效应,这为理解基因间复杂的功能互作关系提供了宝贵的数据。通过进一步的分析,这些数据可以被用来构建更精细的细胞功能模型,为系统生物学研究提供有力支持。
其次,在药物开发中,了解特定基因突变对细胞功能的影响可以帮助识别潜在的药物靶点。例如,筛查中表现出重要性的基因突变可以进一步研究其在疾病中的作用,从而开发针对这些基因的靶向药物。尤其是在癌症研究中,某些突变与的增殖和迁移密切相关,识别这些关键突变为癌症治疗提供了新的突破口。
最后,在个性化医学领域, 引导编辑 凭借其高精确度和低脱靶效应,有望成为一种强大的基因治疗工具。通过修复患者特定的基因突变,研究人员能够在不引入非目标突变的情况下,精准地纠正与疾病相关的基因缺陷。这种个性化的基因修复方法为治疗许多传统上难以治愈的遗传疾病提供了可能性。例如,对于一些单基因遗传病,如囊性纤维化或杜氏肌症, 引导编辑 有望提供永久性的治疗方案。
挑战与改进的路径
尽管 引导编辑 在精准基因编辑方面展现出巨大的潜力,但仍存在一些需要克服的挑战。例如,如何进一步提高编辑效率仍是未来研究的关键问题。在该研究中,MMR的敲除显著提高了编辑效率,但这一方法需要对细胞进行大量工程改造,这可能不适用于所有类型的细胞。此外,如何优化epegRNA的设计以进一步提高其效率和特异性,也是未来研究的重要方向。
对于较大规模的插入或删除(insertion/deletion,indel),MMR的抑制可能不会显著提高编辑效率,因此在此领域还需要更多的技术改进。例如,未来可能会开发出更稳定的epegRNA或新的编辑酶,以提高编辑效率和精确度。同时,针对不同细胞类型和基因背景,如何调整引导编辑系统的各个组成部分,以达到最优的编辑效果,仍然是需要深入探讨的科学问题。
基因编辑的安全性也是实现临床应用的一大障碍。虽然 引导编辑 技术具有较低的脱靶效应,但在治疗人类疾病时,必须确保编辑的特异性和安全性。因此,未来的研究应着力于开发更加安全的编辑工具,减少潜在的脱靶效应,使得该技术能够安全、有效地应用于临床治疗。
总的来说,该研究通过优化 引导编辑 平台,展示了其在多重基因筛查中的巨大应用潜力。通过高效的epegRNA文库和MMR缺失背景下的高效编辑,研究人员成功实现了大量基因突变的高效筛查,并揭示了这些突变对细胞生长的显著影响。这一成果为基因功能的研究提供了强有力的工具,并为基因编辑技术的进一步发展奠定了基础。
随着技术的不断改进,我们相信, 引导编辑 将在功能基因组学、疾病研究和基因治疗中发挥关键作用,为更好地理解和治疗遗传疾病提供新的可能性。通过持续优化编辑系统和扩大其应用范围, 引导编辑 有望成为下一代基因编辑的核心工具之一,无论是在基础研究还是临床应用中,都具有广阔的前景。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 维生素K2 MenaQ7:解锁儿童身高潜能的“生物导航官” (2025-10-28)
- Science:城市咬人蚊子的起源揭示了西尼罗河病毒从鸟类向人类扩散的上升趋势 (2025-10-28)
- 护肝片哪个牌子好?2025 权威榜单:吉利肝领跑,改善肝指标有实证 (2025-10-28)
- 护肝片哪个牌子效果最好?2025实测TOP10曝光,吉利肝(GRANVER)稳居第一 (2025-10-28)
- 告别鼻炎折磨!三大新型疗法,自由呼吸选择 (2025-10-28)
- 南京正大天晴“肠道健康中国行”武汉站启动,多方协同以公益践行健康使命 (2025-10-28)
- Science:神经肌肉受体“启动”状态的发现可能指导未来的药物设计 (2025-10-28)
- 研究揭示全局特征注意的皮层下神经机制 (2025-10-28)
- 当AI赶上医疗,会碰撞出怎么的聪明火花? (2025-10-28)
- 吉林做好2026年城乡住民根本医疗保险参保缴费任务 (2025-10-28)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















